Pytanie 1
Metoda oczyszczania substancji oparta na różnicach w rozpuszczalności poszczególnych składników w określonym rozpuszczalniku to
Wynik: 24/40 punktów (60,0%)
Wymagane minimum: 20 punktów (50%)
Metoda oczyszczania substancji oparta na różnicach w rozpuszczalności poszczególnych składników w określonym rozpuszczalniku to
Ile gramów cukru trzeba dodać do 200 gramów wody o temperaturze 20°C, aby uzyskać roztwór nasycony?
Jakie jest stężenie molowe roztworu, jeśli w 100 cm3 roztworu znajduje się 5,6 g KOH?
MK = 39 g/mol, MO = 16 g/mol, MH = 1 g/mol
Roztwory o ściśle określonym stężeniu, używane w analizach miareczkowych, nazywamy
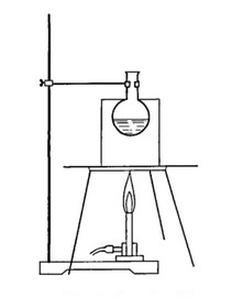
Na rysunku przedstawiono ogrzewanie kolby z cieczą w łaźni
Transportuje się pobrane próbki wody do analiz fizykochemicznych
Ropa naftowa stanowi mieszankę węglowodorów. Jaką metodę wykorzystuje się do jej rozdzielania na składniki?
Co oznacza skrót AKT?
Odlanie cieczy z nad osadu to
Destylacja to metoda
Aby przygotować 500 g roztworu o stężeniu 10% (m/m), ile substancji należy odważyć?
Na etykiecie odważki analitycznej znajduje się napis: Z odważki tej można przygotować
Odważka analityczna azotan(V) srebra(I) AgNO3 0,1 mol/dm3 |
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
Aby przeprowadzić syntezę substancji organicznej w temperaturze 150°C, należy zastosować łaźnię
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
Transformacja zolu w żel to zjawisko określane jako
Na podstawie danych w tabeli próbkę, w której będzie oznaczany BZT, należy przechowywać
| Oznaczany parametr | Rodzaj naczynia do przechowywania | Sposób utrwalania | Dopuszczalny czas przechowywania |
|---|---|---|---|
| barwa | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C | 24 h |
| fosforany ogólne | szklane lub polietylenowe | - zakwaszenie kwasem siarkowym(VI) - schłodzenie do temperatury 2-5°C | 4 h 48 h |
| BZT | szklane | - schłodzenie do temperatury 2-5°C - przechowywanie w ciemności | 24 h |
| azot azotanowy(V) | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C - dodanie 2 cm3 chloroformu do 1 dm3 próbki | 24 h 48 h |
Proces nitrowania najczęściej realizuje się, stosując organiczny substrat
Przedstawiono wyciąg z karty charakterystyki substancji chemicznej. Na podstawie informacji zawartej w zamieszczonym fragmencie karty wskaż wzór chemiczny substancji, której można użyć jako materiału neutralizującego lodowaty kwas octowy.
Kwas octowy lodowaty 99,5% Materiały zapobiegające rozprzestrzenianiu się skażenia i służące do usuwania skażenia Jeżeli to możliwe i bezpieczne, zlikwidować lub ograniczyć wyciek (uszczelnić, zamknąć dopływ cieczy, uszkodzone opakowanie umieścić w opakowaniu awaryjnym). Ograniczyć rozprzestrzenianie się rozlewiska przez obwałowanie terenu; zebrane duże ilości cieczy odpompować. Małe ilości rozlanej cieczy przysypać niepalnym materiałem chłonnym (ziemia, piasek oraz materiałami neutralizującymi kwasy, np. węglanem wapnia lub sodu, zmielonym wapieniem, dolomitem), zebrać do zamykanego pojemnika i przekazać do zniszczenia. Zanieczyszczoną powierzchnię spłukać wodą. Popłuczyny zebrać i usunąć jako odpad niebezpieczny. |
Intensywna reakcja z FeCl3 jest wykorzystywana do identyfikacji
Przedstawiony na rysunku sprzęt służy do

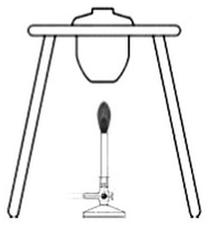
Na rysunku przedstawiono
Ile gramów chlorku baru powinno się rozpuścić w wodzie, aby uzyskać 200 cm3 roztworu o stężeniu 10% i gęstości 1,203 g/cm3?
Wskaż definicję fiksanali?
Piktogramem przedstawionym na rysunku znakuje się opakowanie substancji

Zestaw przedstawiony na rysunku służy do
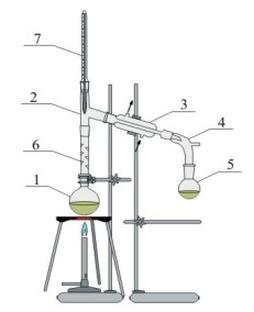
Aby ustalić miano roztworu wodnego NaOH, należy zastosować
Woda używana w laboratorium chemicznym, uzyskana poprzez filtrację przez wymieniacz jonowy, jest określana mianem wody
Reagent, który reaguje wyłącznie z jednym konkretnym jonem lub związkiem, nazywamy reagente
Wskaż jaka zawartość chlorków w próbce wody pozwala na wykorzystanie tej wody do produkcji betonu zgodnie z normą PN-EN 1008.
| Wymagania dotyczące zawartości chlorków w wodzie do produkcji betonu według normy PN-EN 1008 | |
| substancja | dopuszczalna wartość w mg/dm3 |
| chlorki | 1000 |
Procedura przygotowania roztworu Zimmermana-Reinharda
70 g MnSO4·10H2O rozpuścić w 500 cm3 wody destylowanej, dodając ostrożnie 125 cm3 stężonego H2SO4 i 125 cm3 85% H3PO4, ciągle mieszając. Uzupełnić wodą destylowaną do objętości 1dm3.
Który zestaw ilości odczynników jest niezbędny do otrzymania 0,5 dm3 roztworu Zimmermana-Reinharda, zgodnie z podaną procedurą?
| MnSO4·10H2O [g] | Stężony H2SO4 [cm3] | 85% H3PO4 [cm3] | Woda destylowana [cm3] | |
|---|---|---|---|---|
| A. | 35 g | 62,5 cm3 | 62,5 cm3 | ok. 370 cm3 |
| B. | 35 g | 62,5 cm3 | 62,5 cm3 | ok. 420 cm3 |
| C. | 70 g | 125 cm3 | 125 cm3 | ok. 500 cm3 |
| D. | 70 g | 125 cm3 | 125 cm3 | ok. 800 cm3 |
Wagi laboratoryjne można klasyfikować według nośności oraz precyzji na
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych. | |
|---|---|
| Oznaczenie | Sposób utrwalania i przechowywania |
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO₃ |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1-2 z użyciem H₂SO₄ |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO₃ |
| Żelazo | pH 1-2 z użyciem HNO₃ |
| Utlenialność | pH1-2 z użyciem H₂SO₄. Przechowywać w ciemności |
Aby w badanej próbie w trakcie zmiany pH nastąpiła zmiana barwy na malinową, należy użyć
| Zmiany barw najważniejszych wskaźników kwasowo-zasadowych | ||||
|---|---|---|---|---|
| Wskaźnik | Barwa w środowisku | Zakres pH zmiany barwy | ||
| Kwasowym | Obojętnym | Zasadowym | ||
| oranż metylowy | czerwona | żółta | żółta | 3,2÷4,4 |
| lakmus (mieszanina substancji) | czerwona | fioletowa | niebieska | 4,5÷8,2 |
| fenoloftaleina | bezbarwna | bezbarwna | malinowa | 8,2÷10,0 |
| wskaźnik uniwersalny (mieszanina substancji) | czerwona (silnie kwaśne) pomarańczowa (słabo kwaśne) | żółta | niebieska (silnie zasadowe) zielona (słabo zasadowe) | co jeden stopień skali |
| herbata | żółta | czerwona-brunatna | brązowa | |
| sok z czerwonej kapusty | fioletowa | niebieska | zielona | |
Urządzeniem pomiarowym nie jest
W celu przeprowadzenia opisanego doświadczenia, należy przygotować:
| Opis procesu wydzielenia kwasu acetylosalicylowego z tabletek |
|---|
| Pięć rozgniecionych tabletek aspiryny (polopiryny) umieszcza się w kolbie stożkowej o pojemności 100 ml, dodaje 10 ml etanolu i ogrzewa na łaźni wodnej, aż do momentu rozpadnięcia się tabletek. W roztworze znajduje się kwas acetylosalicylowy, natomiast masa tabletkowa pozostaje w osadzie. Osad ten odsącza się na ogrzanym lejku szklanym zaopatrzonym w sączek karbowany. Do odebiornego przesączu dodaje się 20-30 ml zimnej wody destylowanej. Dodatek wody powoduje wypadanie osadu aspiryny z roztworu (zmniejsza się rozpuszczalność aspiryny w roztworze wodno-alkoholowym). Wydzielone kryształy odsączyć na lejku sitowym i suszyć na powietrzu. |
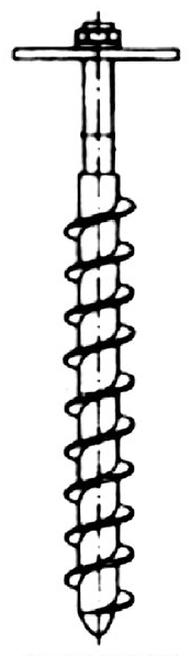
Na rysunku pokazano przyrząd do poboru próbek
Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.