Pytanie 1
Którym skrótem oznacza się tomografię komputerową wysokiej rozdzielczości?
Wynik: 29/40 punktów (72,5%)
Wymagane minimum: 20 punktów (50%)
Którym skrótem oznacza się tomografię komputerową wysokiej rozdzielczości?
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Jednostką indukcji magnetycznej jest
W ułożeniu do rentgenografii AP stawu kolanowego promień główny pada
Który obszar napromieniania w radioterapii oznacza się skrótem PTV?
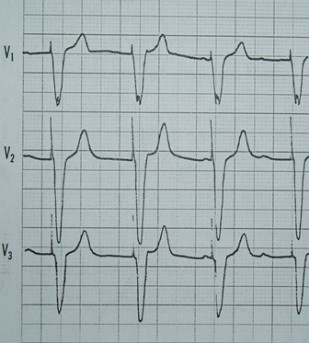
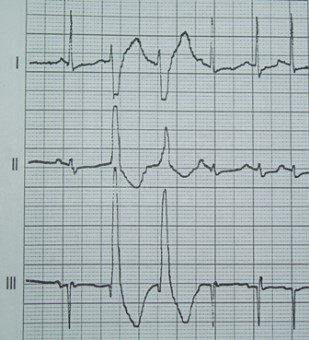
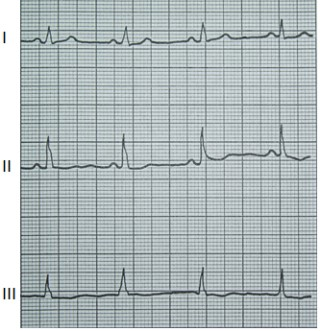
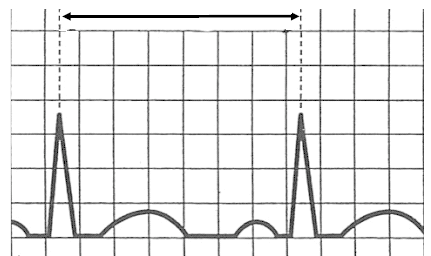
Na którym z zapisów EKG została uwidoczniona fala Pardee'go?
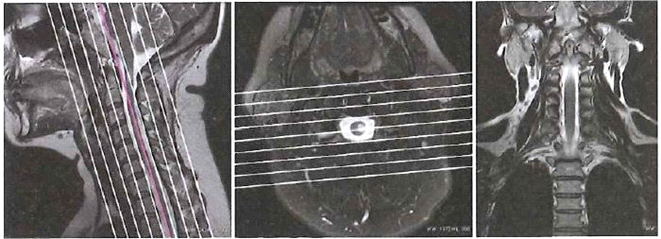
Obrazy MR kręgosłupa szyjnego przedstawiają etap planowania badania warstw
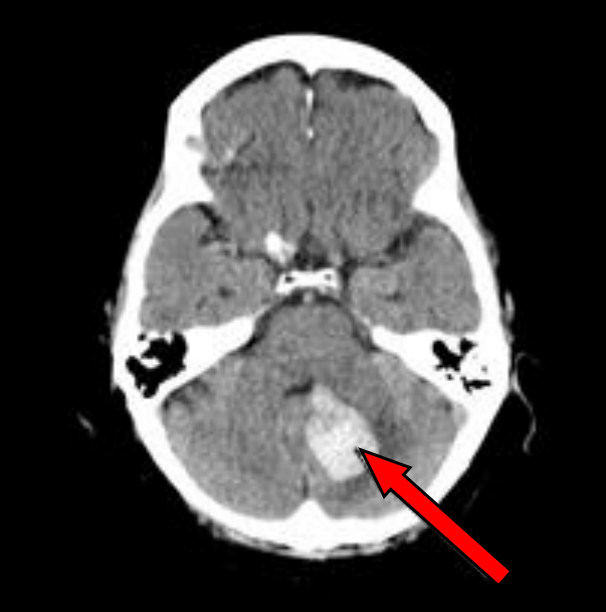
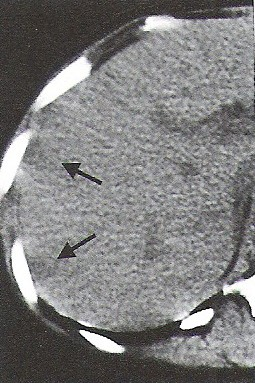
Na przekroju poprzecznym TK mózgu strzałką wskazano obszar
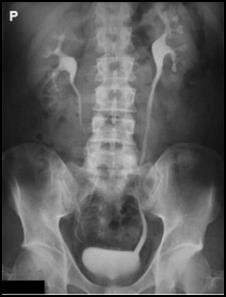
Przedstawiony obraz został zarejestrowany podczas wykonania
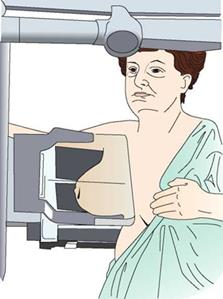
Na ilustracji przedstawiono pozycjonowanie pacjentki do badania mammograficznego w projekcji
Na schemacie oznaczono
Do zdjęcia rentgenowskiego kręgosłupa piersiowego w projekcji AP pacjenta należy ułożyć
Jaki kolor ma warstwa korowa kości w badaniu MR na obrazie T1- zależnym?
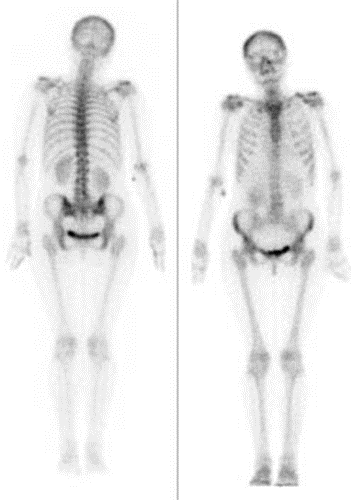
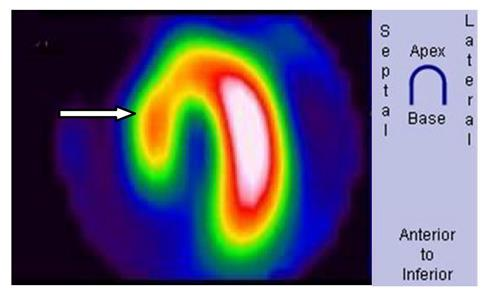
Na obrazie scyntygrafii perfuzyjnej serca strzałką wskazano ścianę
Obiektywną metodą badania słuchu jest audiometria
W technice napromieniania SSD mierzona jest odległość źródła promieniowania
Jednym z kryteriów poprawnie wykonanego badania spirometrycznego jest czas trwania natężonego wydechu, który powinien wynosić u osób powyżej 10 roku życia co najmniej
W której technice obrazowania zostają zarejestrowane jednocześnie dwa przeciwbieżne kwanty promieniowania gamma o równej energii 511 keV?
Zamieszczony rentgenogram został zarejestrowany podczas wykonania
„Ognisko zimne” w obrazie scyntygraficznym określa się jako
Wskaż przyczynę powstania artefaktu widocznego na obrazie MR.
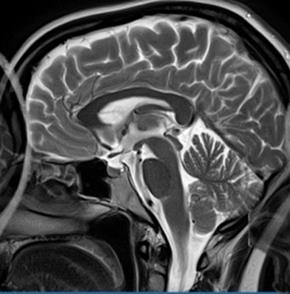
W pracowni ultrasonograficznej technik elektroradiolog nie korzysta z przepisów dotyczących
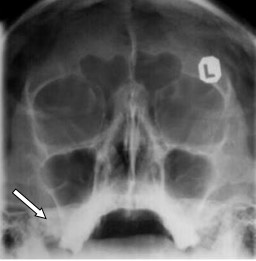
Na radiogramie czaszki strzałką zaznaczono
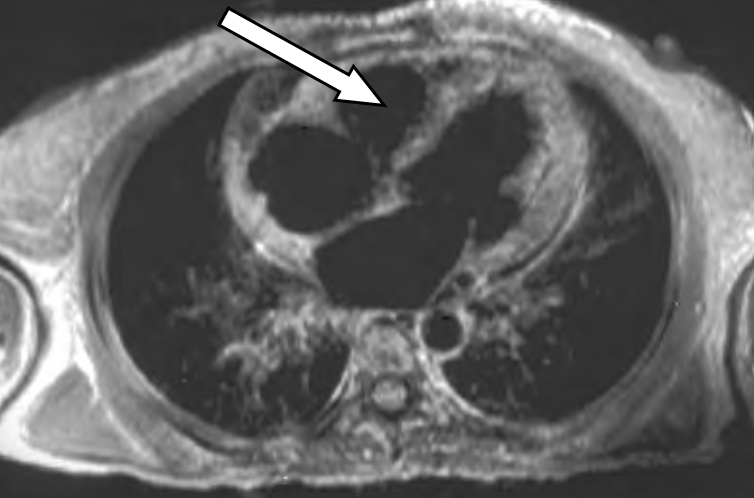
Na skanie rezonansu magnetycznego serca oznaczono
Testy podstawowe z zakresu geometrii pola rentgenowskiego, przeznaczone do sprawdzenia zgodności pola wiązki promieniowania rentgenowskiego z symulacją świetlną, są wykonywane raz
Bezwzględnym przeciwwskazaniem do badania spirometrycznego jest
Jak oznacza się w systemie międzynarodowym czwarty górny ząb mleczny po stronie prawej?
Podstawowym elementem diagnostycznym aparatury izotopowej wykorzystującej emisyjne metody pomiaru jest
Chorobą układu oddechowego typu obturacyjnego jest
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
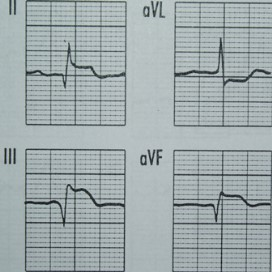
W zapisie EKG załamki P dodatnie w odprowadzeniu I i II, a ujemne w aVR oraz częstotliwość rytmu mniejsza niż 60/min wskazują na
Wskaż osłonę radiologiczną, która jest stosowana w pracowniach radiodiagnostyki stomatologicznej.




Zestaw rentgenogramów przedstawia
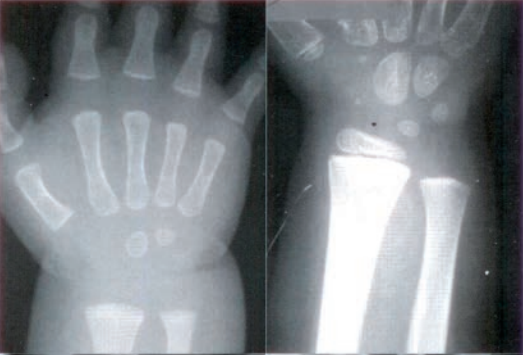
Do czego służy do symulator rentgenowski wykorzystywany w procesie radioterapii?
Na którym obrazie TK uwidoczniony jest artefakt spowodowany ruchami oddechowymi pacjenta?
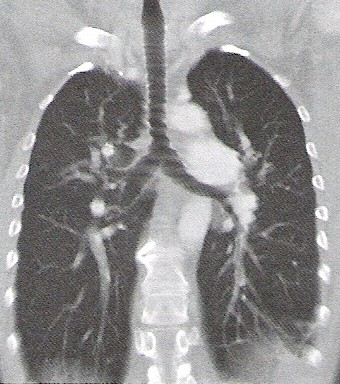

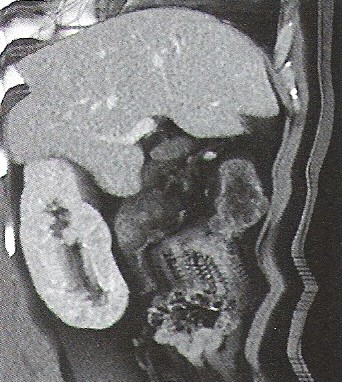
Rytm alfa i beta rejestruje się podczas badania
Który typ głowicy ultrasonograficznej przedstawiono na ilustracji?

Promieniowanie rentgenowskie powstaje w wyniku hamowania
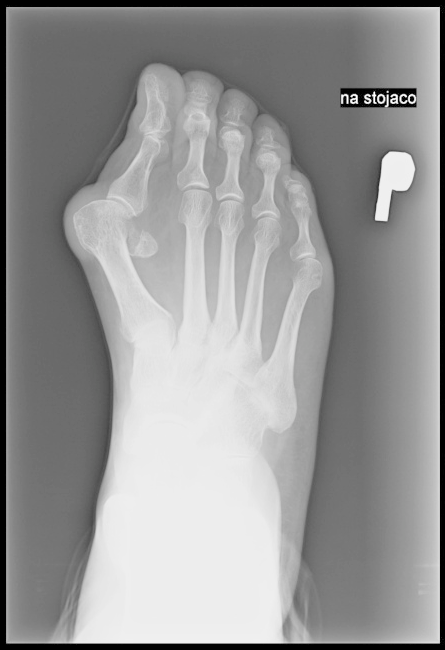
Którą kość zaznaczono strzałką na radiogramie stopy?
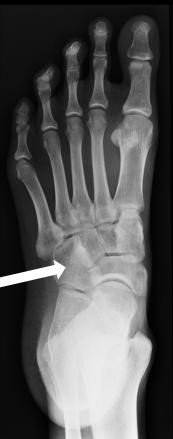
Na radiogramie uwidoczniono