Pytanie 1
Substancją wskaźnikową w miareczkowaniu alkacymetrycznym nie jest
Wynik: 20/40 punktów (50,0%)
Wymagane minimum: 20 punktów (50%)
Substancją wskaźnikową w miareczkowaniu alkacymetrycznym nie jest
Sprawdzano świeżość kilku tłuszczów, oznaczając dla nich LK - liczbę kwasową i LOO - liczbę nadtlenkową. Wyniki analizy oraz maksymalne dopuszczalne wartości liczb charakterystycznych zestawiono w tabeli. Na podstawie informacji zawartych w tabeli wskaż tłuszcze, które są nieświeże.

Dział analizy objętościowej, który dotyczy reakcji zobojętniania, to
Przeprowadzano analizę jakościową próbki według schematu:
Badana próbka zawierała kation
| badany roztwór zawierający jony X2+ | |
| + roztwór HCl | |
| XCl2↓ biały osad | |
| + H2O: ogrzać | |
| roztwór X2+: podzielić na 2 części | |
| + roztwór KI | oziębić |
| XI2 żółty osad | XCl2↓ biały osad |
Na czym polega odwrotne miareczkowanie?
Jaką metodę wykorzystuje się do identyfikacji cukrów redukujących?
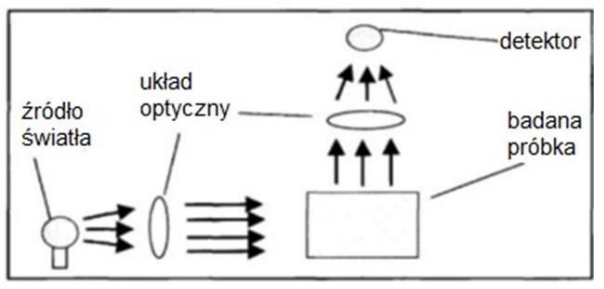
Na ilustracji przedstawiono bieg promieni świetlnych
W Polsce normy dotyczące pyłów zawieszonych PM10 są określone na trzech poziomach (dobowych):
- poziom dopuszczalny 50 ug/m3 - oznacza, że jakość powietrza nie jest zadowalająca, ale nie wywołuje poważnych skutków dla zdrowia ludzi.
- poziom informacyjny 200 ug/m3 - oznacza, że stan powietrza jest zły i należy ograniczyć aktywności na świeżym powietrzu, gdyż normę przekroczono czterokrotnie.
- poziom alarmowy 300 ug/m3 - wskazuje, że jakość powietrza jest bardzo zła, norma przekroczona sześciokrotnie i konieczne jest zdecydowane ograniczenie pobytu na zewnątrz, a najlepiej pozostać w domu, szczególnie dla osób chorych.
Na stacji Monitoringu Środowiska przeprowadzono pomiary zanieczyszczenia powietrza pyłem PM10, uzyskując średnią dobową wartość 0,25 mg/m3. Z analizy wynika, że
Aby obliczyć wartość absorbancji substancji X, dokonano pomiaru absorbancji mieszaniny X i Y oraz samej substancji Y przy tych samych długościach fali. Jeśli AX+Y = 0,84, a AY = 0,56, to jaką wartość ma AX?
Klasyfikacja kwasowości soku owocowego jest związana z metodami
Drobnoustroje posiadające zdolność do rozkładu białek oraz peptydów charakteryzują się właściwościami
Techniką polegającą na mierzeniu siły elektromotorycznej ogniwa składającego się z dwóch elektrod umieszczonych w analizowanym roztworze jest
Jakie jest przeznaczenie próby jodowej, m.in. w produkcji piwa?
Urządzenie Orsata jest wykorzystywane do pomiaru
Czym jest wskaźnik metalochromowy?
Widoczne bez użycia mikroskopu skupisko mikroorganizmów, które powstało z jednej komórki na płytce z podłożem hodowlanym, to
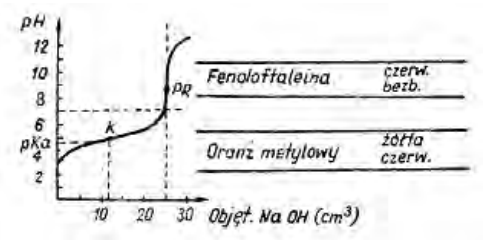
Zamieszczony wykres przedstawia krzywą miareczkowania
Aby utrzymać stałe pH roztworu miareczkowanego w analizach kompleksometrycznych, należy zastosować roztwory buforowe, które charakteryzują się
W badaniach dotyczących kinetyki hydrolizy sacharozy wykorzystuje się mierzenie aktywności optycznej cukrów, które określa się
Wykonano analizę mikrobiologiczną próbki wody wodociągowej o objętości 100 ml i uzyskano wyniki:
Wymagania mikrobiologiczne, jakim powinna odpowiadać woda wodociągowa wprowadzana | |||
|---|---|---|---|
| Lp. | Parametr | Wartość parametryczna | |
| liczba mikroorganizmów [jtk lub NPL] | objętość próbki [ml] | ||
| 1. | Escherichia coli | 0 | 250 |
| 2. | Enterokoki | 0 | 250 |
| 3. | Pałeczka ropy błękitnej (Pseudomonas aeruginosa) | 0 | 250 |
| 4. | Ogólna liczba mikroorganizmów w 36±2°C | 20 | 1 |
| 5. | Ogólna liczba mikroorganizmów w 22±2°C | 100 | 1 |
| Escherichia coli | nieobecne |
| Enterokoki | nieobecne |
| Pałeczki ropy błękitnej | nieobecne |
| Ogólna liczba mikroorganizmów w 37°C | 1200 |
| Ogólna liczba mikroorganizmów w 22°C | 11000 |
Jakiego koloru płomień uzyskuje się dzięki sole miedzi?
Z danych zawartych w tabeli wynika, że gazem w warunkach standardowych jest związek oznaczony numerem
| Wybrane właściwości fizyczne czterech różnych związków organicznych | ||||
|---|---|---|---|---|
| Związek organiczny | Temperatura topnienia [°C] | Temperatura wrzenia [°C] | Gęstość [g/cm³] | Rozpuszczalność w wodzie |
| 1. | 5,5 | 80,0 | 0,8765 | słaba |
| 2. | -95,0 | 110,62 | 0,8623 | nie rozpuszczalny |
| 3. | -182,8 | - 88,6 | 0,0012 | nie rozpuszczalny |
| 4. | -114,1 | 78,2 | 0,7893 | miesza się bez ograniczeń |
Obecność skrobi w bulwie ziemniaka można wykryć, stosując
Rodzaj chromatografii, w której rozdzielanie składników następuje na podstawie różnic w rozpuszczalności osadów formujących się w wyniku reakcji między jonami w roztworze a osadzonym na nośniku reagentem strącającym, określa się mianem chromatografii
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Reakcja: MnO4- + 8H+ + 5e- → Mn2+ + 4H2O jest wykorzystywana w metodzie analizy jakościowej, określanej jako
Spektrofotometria w podczerwieni (IR) to technika bazująca na absorpcji promieniowania w zakresie długości fal
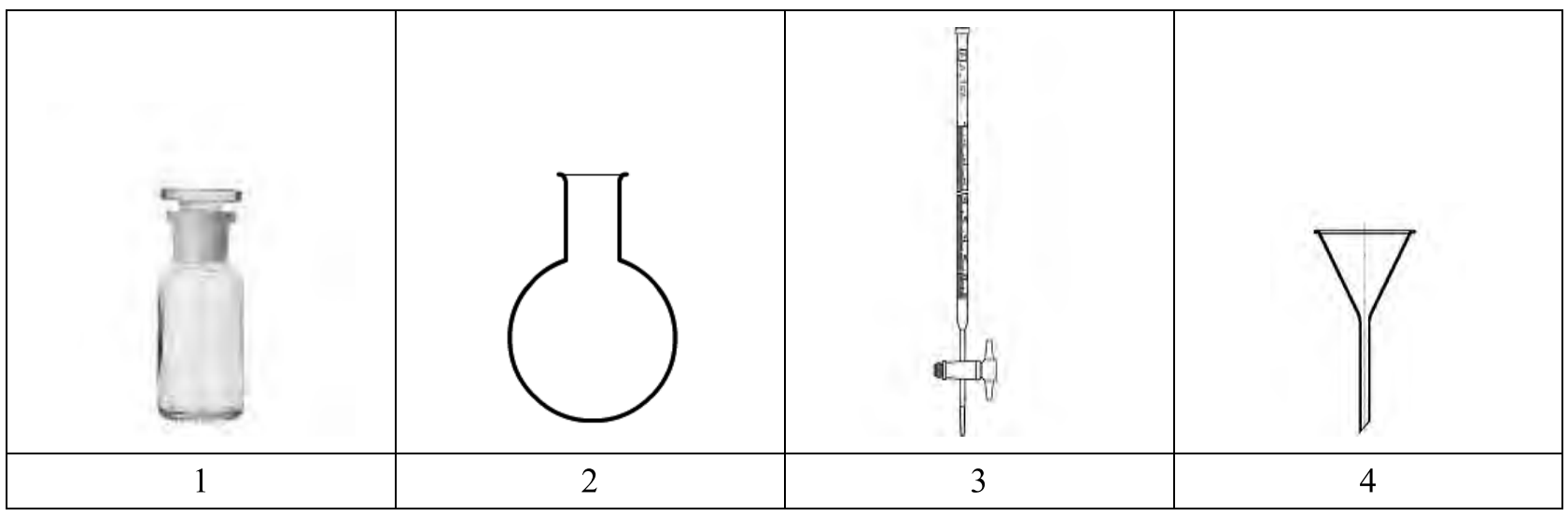
Korzystając z rysunków zamieszczonych w tabeli, wybierz zestaw sprzętu potrzebnego do oznaczania CO2 w wodach powierzchniowych metodą miareczkową.
Wszelkie działania, które powinny zostać podjęte w celu usunięcia zidentyfikowanej niezgodności CCP (krytyczne punkty kontroli) w systemie HACCP, to działania
System HACCP – System Analizy Zagrożeń i Krytycznych Punktów Kontroli, stanowi zbiór wzajemnie powiązanych ze sobą procedur, które w całości tworzą system zarządzania bezpieczeństwem żywności.
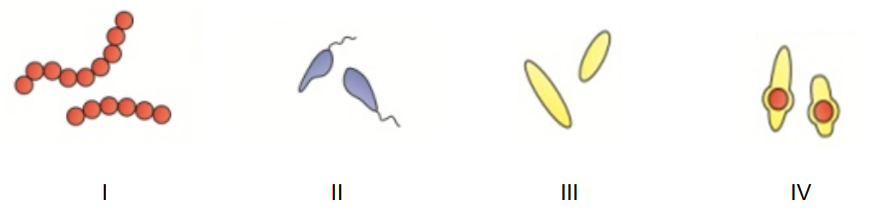
Które ilustracje przedstawiają formy cylindryczne bakterii?
Oblicz ilość amoniaku w badanej próbce, jeśli do jej zmiareczkowania wykorzystano 20,0 cm3 roztworu HCl o stężeniu 0,1 mol/dm3.
W ramce opisano
| Jest to system zapewnienia jakości badań, odnoszący się do procesów organizacyjnych i warunków w jakich niekliniczne badania z zakresu bezpieczeństwa i zdrowia człowieka i środowiska są planowane, przeprowadzane, monitorowane, zapisywane, przechowywane i sprawozdawane. |
Na podstawie przeprowadzonych badań wiadomo, że dany odczynnik chemiczny ma czystość równą 99,998%. Jak się go oznacza?
Wartość liczby estrowej (LE), określona ilością miligramów KOH potrzebnych do zmydlenia estrów w 1 g analizowanego tłuszczu, wskazuje
W literaturze chromatografię określa się skrótem GC
Podczas elektrolizy wodnego roztworu kwasu solnego na katodzie zachodzi reakcja opisana równaniem
| A. | 2 H2O + 2e− → H2 + 2 OH− |
| B. | 2 H2O + 4e− → 4H+ + O2 |
| C. | 2 Cl− → Cl2 + 2e− |
| D. | 2 H+ + 2e− → H2 |
Na podstawie danych w tabeli określ, który odczynnik należy dobrać, aby wykryć fenyloalaninę metodą chromatografii bibułowej i cienkowarstwowej.
| Substancje wykrywane | Odczynnik | Skład | Efekt barwny |
|---|---|---|---|
| Kwasy karboksylowe | Zieleń bromokrezolowa | 3% roztwór w metanolu z dodatkiem NaOH | Żółte plamy na zielonym tle |
| Aminokwasy | Ninhydryna | 1-2% roztwór w acetonie | Ogrzanie do temp. 110°C charakterystyczne zabarwienie |
| Lipidy | Błękit bromotymolowy | 0,04% roztwór w NaOH o stęż. 0,01 mol/dm3 | Żółte plamy na zielonym tle |
| Barbiturany | Azotan(V) rtęci(II) | 1% roztwór wodny | Czarne lub białe plamy na szarym tle |
Część opisu skutków analizy
(...) generuje kation jednowartościowy, a sole powstałe z tym kationem to w przeważającej mierze substancje trudnorozpuszczalne. Większość jego soli jest bezbarwna. Ten bezbarwny jon ma zdolność do tworzenia jonów kompleksowych, na przykład z tiosiarczanem sodowym. Związki tego kationu są wrażliwe na światło (ciemnieją pod jego działaniem), dlatego powinny być przechowywane w pojemnikach z ciemnego szkła (...) Z opisu wynika, że w analizowanym surowcu jakościowo oznaczano kation
Jak określa się lepkość dynamiczną cieczy?
Gdzie wykorzystuje się efekt Tyndalla?