Pytanie 1
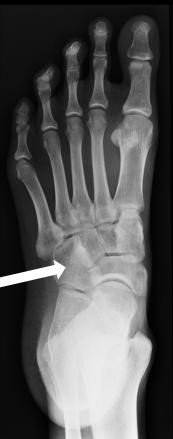
Którą kość zaznaczono strzałką na radiogramie stopy?
Wynik: 29/40 punktów (72,5%)
Wymagane minimum: 20 punktów (50%)
Którą kość zaznaczono strzałką na radiogramie stopy?

Pozytywny środek cieniujący najczęściej stosowany w rentgenodiagnostyce powinien charakteryzować się
Celem radioterapii paliatywnej nie jest
Zdjęcie którego zęba górnego zlecił na skierowaniu lekarz stomatolog?
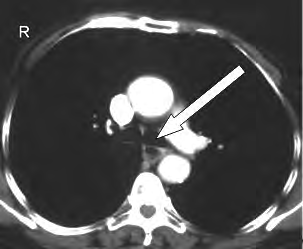
Na obrazie TK klatki piersiowej w przekroju poprzecznym strzałką oznaczono
Chorobą układu oddechowego typu obturacyjnego jest
W audiometrii badanie polegające na maskowaniu (zagłuszaniu) tonów szumem białym to próba
W medycynie nuklearnej wykorzystuje się:
Który załamek odzwierciedla repolaryzację komór w zapisie EKG?
Podczas teleradioterapii piersi lewej narządem krytycznym jest
W celu wyeliminowania zakłóceń obrazu MR przez sygnały pochodzące z tkanki tłuszczowej, stosuje się
Co określa M₀ w systemie klasyfikacji nowotworów TNM?
Planowany obszar napromieniania PTV obejmuje
Parametr spirometryczny czynnościowa pojemność zalegająca oznaczany jest skrótem
Zadaniem technika elektroradiologii w pracowni badań naczyniowych jest
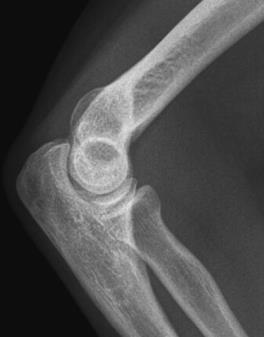
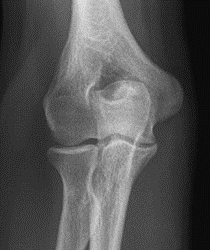
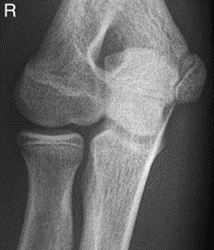
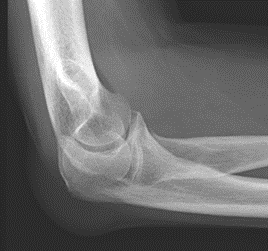
Które zdjęcie RTG stawu łokciowego zostało wykonane w projekcji skośnej w rotacji zewnętrznej?
W sekwencji echa spinowego obraz T2-zależny uzyskuje się przy czasie repetycji TR
Która metoda leczenia onkologicznego zaliczana jest do leczenia systemowego?
Technik elektroradiolog do badania MR kręgosłupa lędźwiowego powinien ułożyć pacjenta:
W badaniu EEG elektrody referencyjne przymocowane do płatka ucha to
Kasety do pośredniej radiografii cyfrowej CR są wyposażone
W radioterapii hadronowej leczenie odbywa się przy użyciu
Czas repetycji w obrazowaniu metodą rezonansu magnetycznego to
Źródłem promieniowania protonowego stosowanego w radioterapii jest
Testy specjalistyczne aparatów rentgenowskich do zdjęć wewnątrzustnych są przeprowadzane
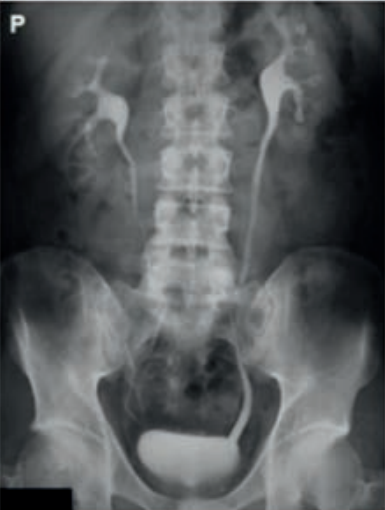
Na rentgenogramie uwidoczniono badanie
Jednym z kryteriów poprawnie wykonanego badania spirometrycznego jest czas trwania natężonego wydechu, który powinien wynosić u osób powyżej 10 roku życia co najmniej
Na ilustracji przedstawiono przygotowanie pacjenta do badania
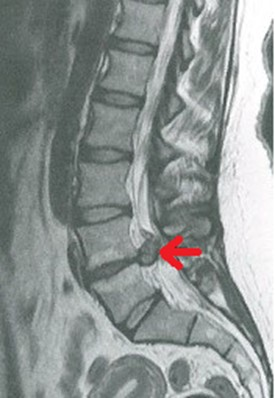
Na obrazie MR kręgosłupa lędźwiowego strzałką wskazano
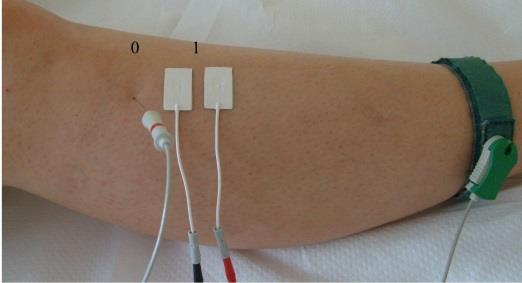
W badaniu EKG różnice potencjałów pomiędzy lewym podudziem a lewym przedramieniem rejestruje odprowadzenie
W zapisie EKG zespół QRS odzwierciedla
Pojawienie się w zapisie EKG patologicznego załamka Q lub QS może wskazywać na
Gruboziarnista folia wzmacniająca wpływa na zwiększenie na obrazie rentgenowskim nieostrości
Badanie metodą Dopplera umożliwia
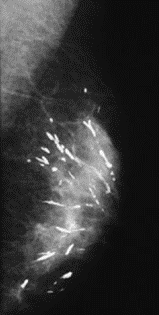
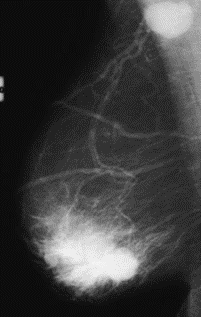
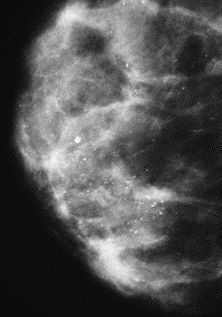
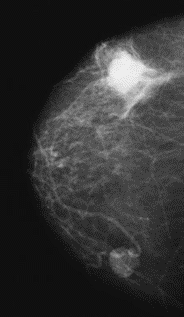
Na którym obrazie rentgenowskim sutka uwidoczniono zmianę patologiczną w obrębie węzłów chłonnych?
W badaniu PET stosuje się tylko radioizotopy emitujące
Rytm alfa i beta rejestruje się podczas badania
Jaka jest moc dawki pochłoniętej w brachyterapii HDR?
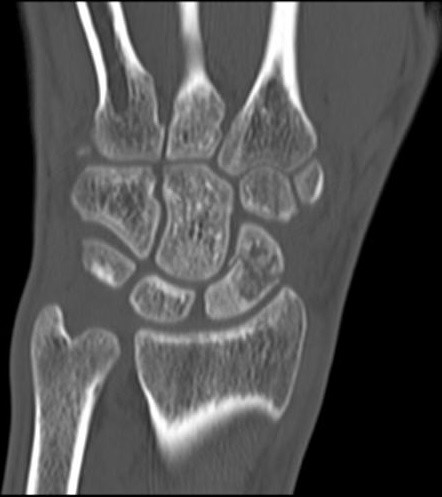
Na obrazie TK nadgarstka uwidocznione jest złamanie kości
W scyntygrafii perfuzyjnej płuc pacjentowi podawany jest radioizotop