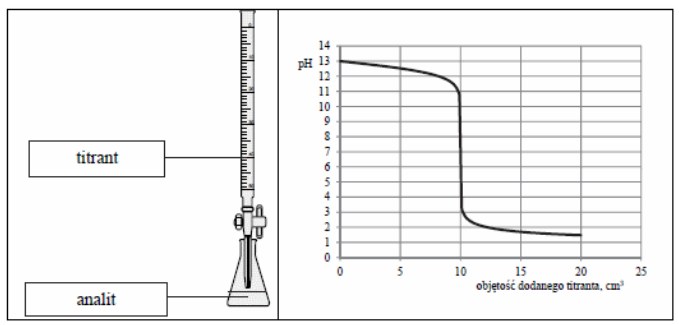
Wodorotlenek sodu (NaOH) jest mocną zasadą, która w roztworach wodnych dysocjuje na jony sodu (Na+) i jony hydroksylowe (OH-). W kontekście analityki chemicznej, wodorotlenek sodu jest często wykorzystywany do miareczkowania kwasów, a jego stężenie można określić przy użyciu różnych metod analitycznych, takich jak miareczkowanie kwasów, titracja kolorimetryczna czy elektrochemiczne pomiary pH. Dodatkowo, wodorotlenek sodu znajduje zastosowanie w różnych procesach przemysłowych, takich jak produkcja mydeł, papieru oraz w oczyszczaniu wód. Jego właściwości chemiczne sprawiają, że jest niezbędnym odczynnikiem w laboratoriach analitycznych, szczególnie do badań dotyczących równowagi kwasowo-zasadowej. Ponadto, zgodnie z aktualnymi normami i dobrymi praktykami w laboratoriach, należy zachować szczególną ostrożność podczas pracy z NaOH, z uwagi na jego silne działanie żrące, co podkreśla znaczenie stosowania odpowiednich środków ochrony osobistej oraz przestrzegania zasad BHP.
Amoniak (NH3) to słaba zasada, która w roztworze nie dysocjuje w pełni, co skutkuje mniejszym stężeniem jonów hydroksylowych w porównaniu do mocnych zasad, takich jak wodorotlenek sodu. Jego zastosowanie w analizie chemicznej jest ograniczone, ponieważ w kontekście titracji kwasów nie zapewnia takiej precyzji, jak mocne zasady. Kwas octowy (CH3COOH) to słaby kwas, który również nie może być analitem w kontekście miareczkowania, ponieważ jego zdolność do uwalniania protonów jest niewielka. Z tego powodu, użycie kwasu octowego do miareczkowania nie pozwala na uzyskanie precyzyjnych wyników, które są wymagane w analizach chemicznych. Kwas solny (HCl) jest mocnym kwasem, ale w kontekście pytania nie jest odpowiedni jako analit, ponieważ jego charakterystyka nie odpowiada typowym zastosowaniom analitycznym, gdzie preferowane są substancje, które można miareczkować z dużą dokładnością. Użycie kwasu solnego w analizie może prowadzić do nieporozumień związanych z interpretacją wyników, zwłaszcza w przypadku reakcji, które nie są jednoznaczne. Niezrozumienie różnicy między mocnymi a słabymi zasadami i kwasami jest typowym błędem myślowym, który może prowadzić do niewłaściwych interpretacji w kontekście praktycznym.