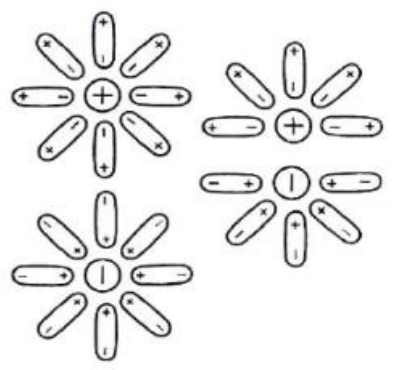
Solwatacja to bardzo ważny proces, który ma miejsce, kiedy rozpuszczamy substancje jonowe w polarnych rozpuszczalnikach, na przykład w wodzie. Na tym rysunku widać, jak cząsteczki wody oblegają jony, co świetnie ilustruje ten proces. Dzięki temu, że cząsteczki wody mają różne ładunki, przyciągają jony dodatnie i ujemne, co sprawia, że te jony są stabilizowane w roztworze. Dobrym przykładem solwatacji jest to, co się dzieje, kiedy rozpuszczamy sól w wodzie — jony sodu i chlorkowe są otaczane przez cząsteczki wody, co pozwala im swobodnie się poruszać. Wiedza o tym procesie jest mega ważna, zwłaszcza w chemii analitycznej czy biochemii. W laboratoriach dobrze jest obserwować solwatację, żeby lepiej zrozumieć, jak zachowują się różne substancje chemiczne, co potem ma duże znaczenie w ich zastosowaniach.
Jeśli wybrałeś odpowiedź dotyczącą dyfuzji, hydrolizy lub okluzji, to mylisz się co do tego, jak to działa w roztworach chemicznych. Dyfuzja to proces, w którym cząsteczki same się rozprzestrzeniają, więc nie potrzebuje żadnego rozpuszczalnika polarnego ani nie wchodzi w interakcje z jonami. Chociaż dyfuzja jest istotna w chemii, to nie opisuje tego, jak cząsteczki rozpuszczalnika stabilizują jony. Z kolei hydroliza to reakcja z udziałem wody, gdzie cząsteczki wody reagują z innymi substancjami, co też nie jest tym samym co solwatacja. W przypadku rozpuszczania substancji jonowych, hydroliza może prowadzić do powstawania nowych związków, a nie tylko ich stabilizacji. A okluzja to zupełnie co innego — tu jony są uwięzione w kryształach innej substancji, co różni się od tego, co dzieje się z cząsteczkami rozpuszczalnika. Mylenie tych procesów może wynikać z nieporozumień, dlatego dobrze jest wiedzieć, jakie są różnice w chemii, bo to pomoże ci lepiej zrozumieć różne mechanizmy.