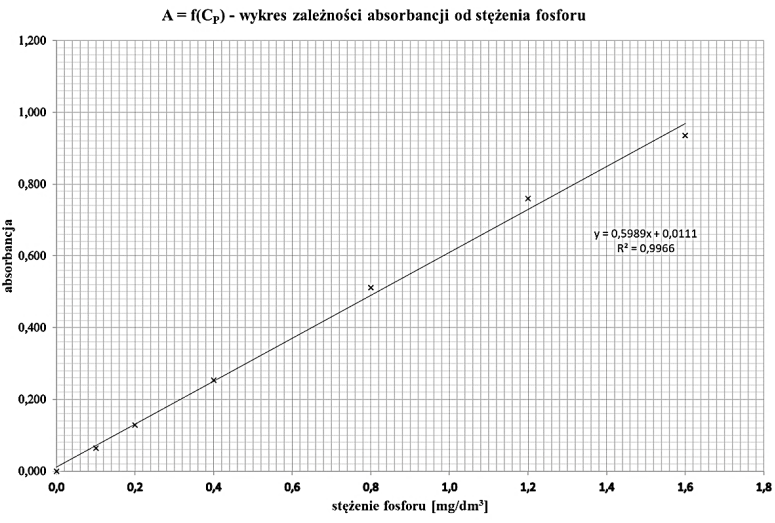
Fajnie, że wskazałeś 1,030 mg/dm3. To jest zgodne z równaniem prostej, które pokazuje, jak absorbancja jest związana z stężeniem fosforu. Mamy tutaj wartość absorbancji A = 0,628, co możemy podstawić do równania, żeby wyliczyć stężenie fosforu. Takie metody są bardzo popularne w laboratoriach chemicznych, szczególnie przy analizie stężenia różnych substancji w roztworach. Dobrze jest wiedzieć, że na przykład w wodzie pitnej ustalanie poziomu fosforu jest istotne dla jakości wody. Normy, które opracowuje Światowa Organizacja Zdrowia, wymagają, żeby monitorować te stężenia, żeby dbać o zdrowie. Znając zależność między absorbancją a stężeniem, można nie tylko dobrze mierzyć, ale też przewidywać, co się wydarzy w różnych warunkach w eksperymentach, co jest naprawdę pomocne w badaniach naukowych i przemyśle.
Jeżeli wybrałeś coś innego niż 1,030 mg/dm3, to pewnie mogło to wynikać z kilku typowych pomyłek. Czasami ludzie mogą źle zrozumieć, jak absorbancja łączy się ze stężeniem i myślą, że zmiany w absorbancji są zawsze proporcjonalne do stężenia, nie biorąc pod uwagę zasadności równania. Inna sprawa to, że interpretacja wykresu może wydawać się subiektywna, co sprawia, że można dojść do błędnych wniosków. Często też zapominają spojrzeć na jednostki miary i mogą pomieszać wartości stężenia, a to w chemii jest mega ważne. W absorbancji zazwyczaj korzysta się z zasady Beer-Lamberta, która mówi, że absorbancja jest proporcjonalna do stężenia i długości drogi optycznej. Jak nie uwzględnimy tego równania, to wyjdą nam błędne wartości. Przykładowo, stężenie fosforu w próbce można pomylić z innymi składnikami, co wprowadza bałagan w analizie. Żeby uniknąć takich wpadek, warto dokładnie przestudiować i zrozumieć wykresy oraz kontekst eksperymentu, bo to są najlepsze praktyki w analizie chemicznej. Pamiętaj, że precyzyjność i dokładność pomiarów to kluczowe kwestie w laboratoriach, a każdy błąd może prowadzić do pomyłek w wnioskach i decyzjach.