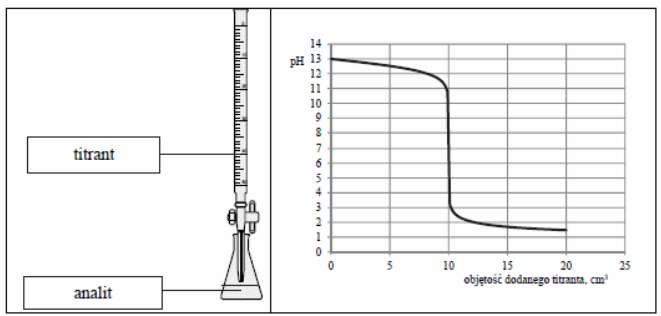
Poprawna odpowiedź to mocna zasada, co znajduje potwierdzenie w analizie wykresu pH, wykazującego charakterystyczny gwałtowny wzrost wartości pH w okolicach punktu równoważności. Titracje mocnej zasady z mocnym kwasem są klasycznym przykładem, gdzie początkowe pH roztworu jest wysokie, a następnie w punkcie równoważności następuje jego szybki spadek. Przykładem zastosowania tej wiedzy jest analiza roztworów amoniaku, które zachowują się jako mocne zasady, co jest istotne w wielu dziedzinach chemii, w tym w chemii analitycznej. W praktyce, znajomość zachowań kwasów i zasad oraz ich reakcji w procesie titracji pozwala na dokładne określenie stężenia substancji czynnych w różnych roztworach. Przeprowadzając titracje, chemicy korzystają z wskaźników pH, co jest zgodne z najlepszymi praktykami analitycznymi, zapewniając wysoką precyzję pomiarów oraz wiarygodność wyników.
Wybór odpowiedzi nieprawidłowej wskazuje na pewne nieporozumienia dotyczące charakterystyki roztworów kwasów i zasad. Odpowiedzi dotyczące słabych kwasów i słabych zasad wynikają z błędnej interpretacji krzywej titracyjnej, która w przypadku takich substancji nie wykazuje gwałtownego wzrostu pH. Słabe kwasy, jak kwas octowy, oraz słabe zasady, takie jak amoniak, charakteryzują się łagodniejszymi zmianami pH w trakcie titracji, co prowadzi do mniej wyraźnych punktów równoważności. W przypadku mocnych kwasów, takich jak kwas solny, oraz mocnych zasad, jak wodorotlenek sodu, zachowanie jest diametralnie różne; mocne substancje w pełni dysocjują w roztworze, co skutkuje gwałtownym wzrostem pH w okolicach punktu równoważności. Typowym błędem w analizie wykresów titracyjnych jest mylenie rozkładu pH w przypadku różnych rodzajów kwasów i zasad, co prowadzi do niewłaściwych wniosków. Aby uniknąć tych błędów, zaleca się uzyskiwanie gruntownej wiedzy na temat teorii kwasów i zasad, a także praktyczne przeprowadzanie titracji dla lepszego zrozumienia zjawisk chemicznych zachodzących w trakcie tych procesów.