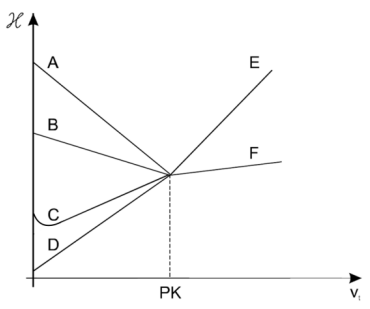
Wybór odpowiedzi C i E jest poprawny, ponieważ na wykresie miareczkowania kwasu octowego za pomocą NaOH przewodnictwo roztworu zmienia się w specyficzny sposób. Zanim osiągnięty zostanie punkt końcowy miareczkowania, przewodnictwo rośnie z powodu reakcji pomiędzy kwasem a zasadowym NaOH, co prowadzi do powstania octanu sodu. Octan sodu, będąc solą, ma lepsze właściwości przewodzące niż kwas octowy, co powoduje wzrost przewodnictwa. Po punkcie końcowym, jeżeli dodawany jest dalszy NaOH, przewodnictwo rośnie ponownie, ponieważ wolne jony OH- wpływają na przewodnictwo roztworu. Przykładowo, w praktycznych zastosowaniach alkacymetrii, technika ta jest wykorzystywana do analizy zawartości kwasów w produktach spożywczych, farmaceutykach oraz w badaniach środowiskowych. Ważne jest, aby zrozumieć, że zmiany przewodnictwa są kluczowym wskaźnikiem w określaniu punktu równoważnikowego miareczkowania. Dobrą praktyką jest prowadzenie miareczkowania pod stałą kontrolą pH, co pozwala na precyzyjniejsze określenie punktu końcowego.
Wybór odpowiedzi D i F, B i F, A i E wskazuje na nieporozumienie dotyczące zjawiska miareczkowania. W przypadku miareczkowania kwasu octowego NaOH, kluczowym aspektem jest zrozumienie, jak przewodnictwo zmienia się w trakcie reakcji chemicznej. Odpowiedzi te sugerują, że uczestnicy testu nie dostrzegli, że przed osiągnięciem punktu końcowego przewodnictwo powinno rosnąć w wyniku reakcji kwasu z zasadą, co prowadzi do powstania soli. Osoby wybierające te odpowiedzi mogły zignorować fakt, że po przekroczeniu punktu równoważnikowego, przewodnictwo wzrasta z powodu obecności wolnych jonów OH-, co nie jest uwzględnione w tych odpowiedziach. Ponadto, mogą występować typowe błędy myślowe, takie jak utożsamianie wzrostu przewodnictwa z innymi procesami chemicznymi, które nie mają miejsca w tym kontekście. Ważne jest, aby zrozumieć mechanizm miareczkowania oraz rolę, jaką odgrywają produkty reakcji w przewodnictwie, co jest podstawą skutecznych analiz chemicznych. Zrozumienie tych zasad jest niezbędne dla poprawności interpretacji wyników oraz stosowania ich w praktyce laboratoryjnej.