Pytanie 1
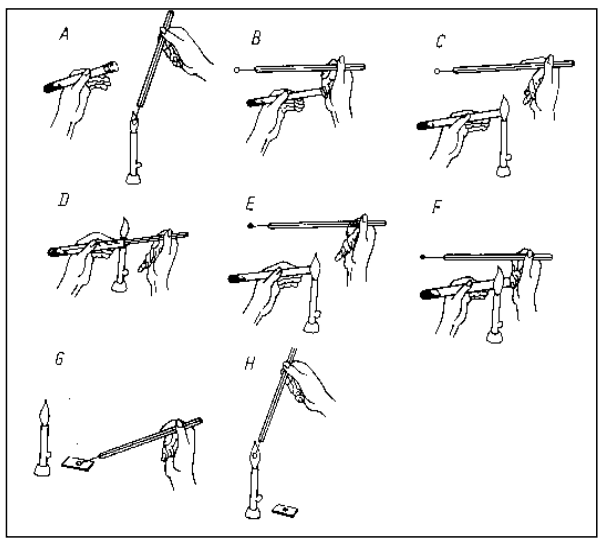
Na schemacie przedstawiającym sposób pobierania hodowli do badań ze skosu agarowego, literą A oznaczono
Wynik: 35/40 punktów (87,5%)
Wymagane minimum: 20 punktów (50%)
Na schemacie przedstawiającym sposób pobierania hodowli do badań ze skosu agarowego, literą A oznaczono

W literaturze chromatografię określa się skrótem GC
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
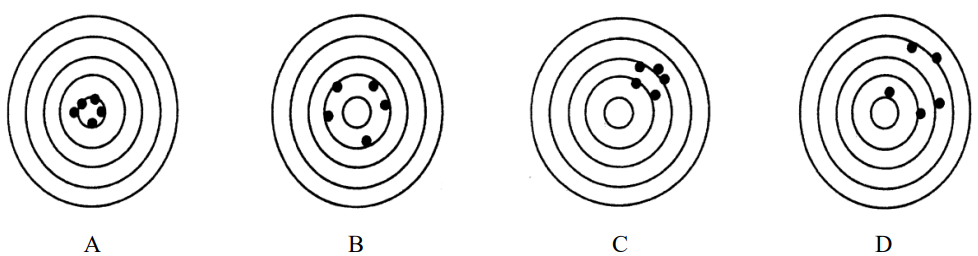
Na rysunkach przedstawiono serie pomiarów o różnej dokładności i precyzji (środek najmniejszego okręgu oznacza wartość prawdziwą). Serię pomiarów precyzyjnych, ale niedokładnych przedstawiono na rysunku
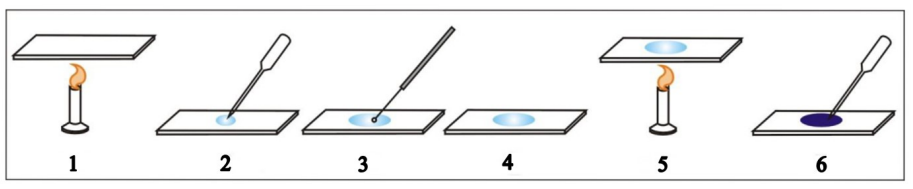
Rysunek przedstawia poszczególne etapy wykonania preparatu mikroskopowego utrwalonego. Cyfrą 3 oznaczono
W tabeli przedstawiono gęstość wodnych roztworów gliceryny w temperaturze 20°C w zależności od jej stężenia wyrażonego w % wagowych.
Z informacji zawartych w tabeli wynika, że stężenie gliceryny o gęstości 1,10 g/cm³ wynosi
| % wagowy gliceryny | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
|---|---|---|---|---|---|---|---|---|---|---|
| [g/cm3] gęstość | 1,022 | 1,047 | 1,072 | 1,099 | 1,126 | 1,153 | 1,180 | 1,208 | 1,235 | 1,261 |
W wyniku pomiaru wagowego uzyskano 0,2451 g tlenku żelaza(III). Jaką masę żelaza zawierała badana próbka? MFe = 55,845 g/mol, MO = 15,999 g/mol?
Do czego służy aparat Soxhleta w kontekście ekstrakcji składnika?
Stosunek masy proszku luźno nasypanego do objętości, którą ten proszek zajmuje, definiuje gęstość
Rozpraszanie promieniowania świetlnego przez cząstki koloidalne, które mają wymiary mniejsze od długości fali światła, to zjawisko
Aby określić wartość absorbancji substancji X, zmierzono, przy tych samych długościach fali, absorbancję mieszaniny X i Y oraz osobno substancji Y.
Jeśli AX+Y = 0,84, a AY = 0,56, to jaka jest wartość AX?
Który z parametrów jakości wody jest nieprawidłowo opisany?
| Mętność | 0,19 NTU | |
| Barwa | Akceptowalna - 10 mg Pt/dm3 | |
| Jon amonowy | 0,15 mg NH4+/dm3 | |
| Twardość | Węglanowa | Stopnie niemieckie |
| 8,01°dH | 140 mg/dm3 | |
W Polsce ustalono normy dla pyłów PM10 na trzech poziomach (dobowych):
- poziom dopuszczalny 50 ug/m3 - oznacza, że jakość powietrza jest niezadowalająca, jednak nie powoduje poważnych skutków dla zdrowia ludzkiego.
- poziom informowania 200 ug/m3 - wskazuje, że jakość powietrza jest zła i konieczne jest ograniczenie aktywności na świeżym powietrzu, ponieważ norma została przekroczona czterokrotnie.
- poziom alarmowy 300 ug/m3 - wskazuje, że jakość powietrza jest bardzo zła, norma została przekroczona sześciokrotnie i należy zdecydowanie ograniczyć przebywanie na zewnątrz, a najlepiej pozostać w domu, zwłaszcza osoby z chorobami.
Na stacji Monitoringu Środowiska dokonano pomiarów zanieczyszczenia powietrza pyłem PM10, uzyskując średnią dobową 0,25 mg/m3. Z przeprowadzonej analizy wynika, że
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wyznaczanie punktu końcowego (PK) miareczkowania przy użyciu metod: graficznej, pierwszej pochodnej oraz Halina jest stosowane w
Określ typ pożywki, która składa się z agarów zwykłych (1000 ml) oraz 5% baraniej krwi (50-100 ml)?
Jakie właściwości cieczy określa areometr?
Wśród wskaźników stosowanych w analizach kompleksometrycznych znajdują się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką metodę analizy ilościowej wykorzystuje się do oznaczania stężenia nadtlenku wodoru w 3% roztworze wody utlenionej?
W celu oceny jakości masła wykonano oznaczenie liczby kwasowej LK, liczby zmydlania LZ i liczby nadtlenkowej LOO. Wyniki zapisano w tabeli. Wartość liczby estrowej LE dla badanego masła wynosi
| Rodzaj liczby | Wartość zmierzona |
|---|---|
| LZ | 196,8 mg KOH/1g |
| LK | 1,2 mg KOH/1g |
| LE | ? |
| LOO | 4,25 milirównoważnika aktywnego tlenu/ kg |
Aby uzyskać gaz w wyniku działania cieczy na ciało stałe, konieczne jest zastosowanie aparatu
Do zmiareczkowania próbki roztworu NaOH wykorzystano 10 cm3 roztworu HCl o stężeniu 0,1 mol/dm3. Ile NaOH (M = 40 g/mol) znajdowało się w próbce?
Proces strącania osadu, który polega na wiązaniu na nim jonów lub cząsteczek, które w roztworze nie wytrąciłyby się samodzielnie, określa się mianem
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W ramce przedstawiono równania reakcji zachodzące podczas oznaczania chlorków metodą
| Ag+ + Cl- → AgCl ↓ |
| Ag+ + SCN- → AgSCN ↓ |
| Fe3+ + SCN- → Fe(SCN)2+ |
Sekcja analizy objętościowej dotycząca reakcji zobojętniania nosi nazwę
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Lepkość oleju napędowego w temperaturze 40°C wynosi 3 mm2/s. Jaką lepkość to określa?
Wśród substancji konserwujących stosowanych w żywności występują CH3COONH4 (E 264) oraz C6H5COONa (E 211). Związki te można określić jako
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Metoda analityczna, która polega na wyznaczaniu masy osadzonej substancji z roztworu z wykorzystaniem azotanu(V) srebra, to
W dwóch niezidentyfikowanych probówkach znajdują się roztwory: w jednej - glukozy, a w drugiej - sacharozy. Jakiego odczynnika należy użyć, aby rozpoznać glukozę?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
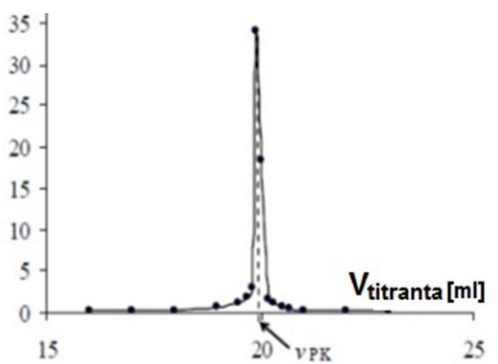
Sporządzono wykres potencjometrycznego miareczkowania alkacymetrycznego. W jaki sposób należy opisać oś Y?
| A. | ΔpH/ΔVtitranta |
| B. | ΔSEM/ΔVtitranta |
| C. | pH/ΔVtitranta |
| D. | SEM/ΔVtitranta |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przy separacji osadu z roztworu za pomocą wirówki laboratoryjnej istotne jest, aby rotor wirówki
Ebuliometr to przyrząd używany do pomiaru temperatury