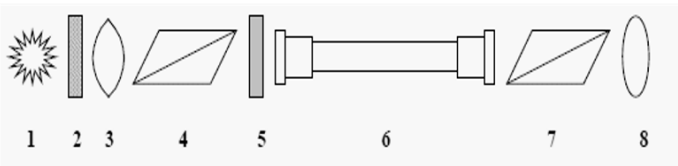
Na schemacie przedstawiono mechanizm działania wskaźników

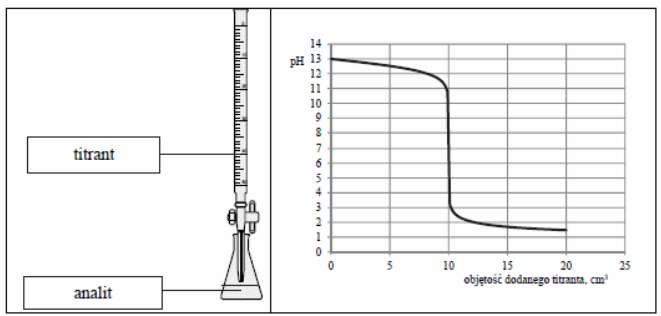
| Ilość wzorcowego roztworu roboczego ołowiu w cm3 | 0,0 | 0,5 | 1,0 | 2,0 | 3,0 |
| Zawartość ołowiu w mg | 0,0 | 0,005 | X | 0,020 | 0,030 |
| Doświadczenie | Wynik doświadczenia |
|---|---|
| Próba Trommera | ceglastoczerwony osad |
| Próba Tollensa | lustro srebrne |
| Próba z wodą bromową w obecności wodorowęglanu sodu | odbarwienie wody bromowej |
| A. Ba2+, Ca2+, Sr2+ |
| B. Fe2+, Mg2+, Pb2+, Al3+, Ca2+ |
| C. Ni2+, Co2+, Fe2+, Fe3+, Mn2+, Zn2+ |
| D. Pb2+, Cu2+, Cd2+, Cr3+, Ag+, K+, Al3+ |
Badanym cukrem była
| Badany roztwór | Dodany odczynnik | Obserwacje |
|---|---|---|
| Probówka 1. | Cu(OH)2 | Zawiesina Cu(OH)2 rozpuściła się, a roztwór przyjął szafirową barwę |
| Cu(OH)2 | Po ogrzaniu probówki pojawił się ceglasto-czerwony osad | |
| Probówka 2. | [Ag(NH3)2]+ | Po ogrzaniu na ściankach probówki pojawiło się srebro metaliczne |
| Probówka 3. | Br2(aq) + roztwór NaHCO3 | Woda bromowa uległa odbarwieniu |
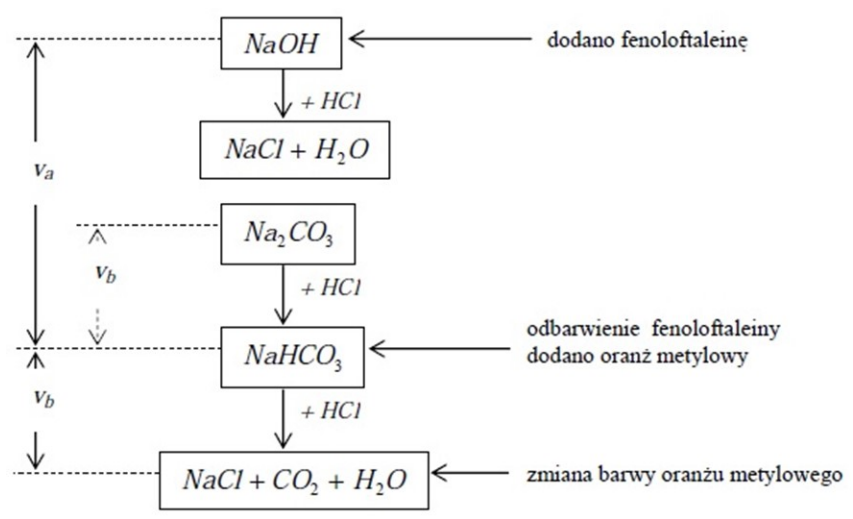
| Odczynnik | Wynik |
|---|---|
| HCl | Brak osadu |
| NaOH | Brunatny koloidalny osad |
| KSCN | Krwistoczerwone zabarwienie roztworu |
| A. | Ni2+, Co2+, Fe2+, Fe3+, Mn2+, Zn2+ |
| B. | Mn2+, Cu2+, Cd2+, Cr3+, Ag+, Zn2+ |
| C. | Fe2+, Mg2+, Pb2+, Al3+, Ca2+ |
| D. | Ba2+, Ca2+, Sr2+ |
Cl2 + 2 I- → I2 + 2 Cl-Na podstawie podanych reakcji można stwierdzić, że w pierwszej kolejności woda chlorowa
I2 + 5 Cl2 + 6 H2O → 2 IO3- + 10 Cl- + 12 H+
stężenie glukozy [mg/cm3] = Ap / Aw · cw Ap - absorbancja próbki Aw - absorbancja wzorca cw - stężenie wzorca [mg/cm3] |
| A. | H2S w roztworze NH3(aq) i NH4Cl. |
| B. | roztwór HCl o stężeniu 2 mol/dm3. |
| C. | (NH4)2CO3 w roztworze NH3(aq) i NH4Cl. |
| D. | H2S w roztworze HCl o stężeniu 0,3 mol/dm3. |
| 1 | 2 | 3 |
| 200 – 400 nm | 400 – 800 nm | 25 – 2,5 μm (4000 – 400 cm-1) |
| Numer wzorca | 1. | 2. | 3. | 4. | 5. |
| Odmierzona ilość roztworu wzorcowego [cm3] | 0 | 1 | 2 | 3 | 4 |
| Barwa w stopniach mg Pt/dm3 | 0 | 5 | 10 | 15 | 20 |
| Objętość badanej próbki wody [cm3] | 100 |
| Wzorzec | 2. |
gdzie:
a – odczytana ze skali wzorców barwa próbki, mg Pt/dm³
V – objętość próbki, cm³
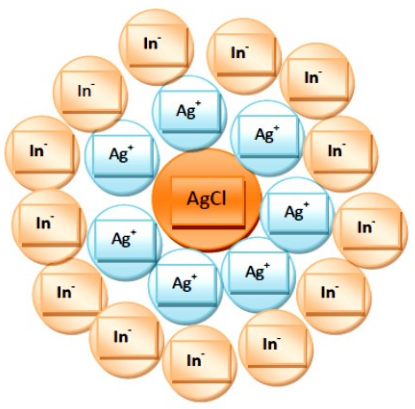
| Ag+ + Cl- → AgCl |
| 2 Ag+ + CrO42- → Ag2CrO4 |
| Wielkość próbki | Skala analizy |
|---|---|
| > 0,1 g | makro |
| 0,01 – 0,1 g | semimikro |
| 0,0001 – 0,01 g | mikro |
| < 10-4 g | ultramikro |
| Podział adsorbentów według zastosowania | |
|---|---|
| Adsorbent | Przykłady zastosowania |
| Tlenek glinu zasadowy | aminy, węglowodory, alkaloidy, zasady heterocykliczne |
| Tlenek glinu obojętny | aminy, amidy, alkaloidy, glikozydy |
| Tlenek glinu kwasowy | barwniki, związki kwasowe |
| Żel krzemionkowy | aminy, kwasy karboksylowe, amidy, węglowodory, inne związki obojętne |
| Do kolby miarowej o pojemności 250 cm3 odpipetować 25 cm3 3% wody utlenionej i dopełnić wodą do kreski. Do kolby stożkowej o pojemności 250 cm3 odpipetować 20 cm3 próbki rozcieńczonej wody utlenionej, dodać 25 cm3 kwasu siarkowego(VI) (1+4) i miareczkować roztworem manganianu(VII) potasu o stężeniu 0,02 mol/dm3 do pojawienia się trwałego różowego zabarwienia. |