W wyniku reakcji 100 g azotanu(V) ołowiu(II) z jodkiem potasu otrzymano 120 g jodku ołowiu(II). Wydajność reakcji wyniosła
| Pb(NO3)2 + 2KI → PbI2 + 2KNO3 | |
| (MPb(NO3)2 = 331 g/mol, MKI = 166 g/mol, MPbI2 = 461 g/mol, MKNO3 = 101 g/mol) |
| Pb(NO3)2 + 2KI → PbI2 + 2KNO3 | |
| (MPb(NO3)2 = 331 g/mol, MKI = 166 g/mol, MPbI2 = 461 g/mol, MKNO3 = 101 g/mol) |
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godziny |
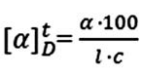
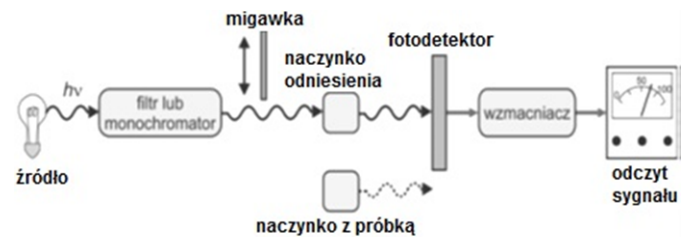
| Przygotowanie skali wzorców do kolometrycznego oznaczania fosforanów(V) | ||||||||
| Do ośmiu cylindrów Nesslera o pojemności 100 cm3 odmierzyć kolejno wzorcowy roztwór roboczy KH2PO4 według poniższej tabeli SKALA WZORCÓW (PO43-) i uzupełnić wodą do kreski. Do każdego cylindra dodać 2 cm3 roztworu molibdenianu amonu (heksaamonoheptamolibdenian(VI)), wymieszać, dodać 0,2 cm3 roztworu SnCl2 i ponownie wymieszać. | ||||||||
| SKALA WZORCÓW (PO43-) | ||||||||
| Wzorcowy roztwór roboczy [cm3] | 0,0 | 0,5 | 1,0 | 2,0 | 3,0 | 5,0 | 7,0 | 10,0 |
| Zawartość PO43- [mg] | 0,0 | 0,005 | 0,01 | 0,02 | 0,03 | 0,05 | 0,07 | 0,10 |
| Roztwór | KH₂PO₄ | (NH₄)₆Mo₇O₂₄ | SnCl₂ |
|---|---|---|---|
| A. | 28,5 cm³ | 8,0 cm³ | 0,16 cm³ |
| B. | 0,285 cm³ | 16,0 cm³ | 1,6 cm³ |
| C. | 28,5 cm³ | 16,0 cm³ | 1,6 cm³ |
| D. | 0,285 cm³ | 8,0 cm³ | 16 cm³ |


Badana próbka zawierała kation
| badany roztwór zawierający jony X2+ | |
| + roztwór HCl | |
| XCl2↓ biały osad | |
| + H2O: ogrzać | |
| roztwór X2+: podzielić na 2 części | |
| + roztwór KI | oziębić |
| XI2 żółty osad | XCl2↓ biały osad |
| Parametr oznaczany | Jednostka | Wartość parametru | |
|---|---|---|---|
| Według specyfikacji | Zbadana analitycznie | ||
| Zawartość wodorotlenku sodu | % | >=98 | 98,3 |
| Zawartość węglanu sodu | % | <=0,4 | 0,39 |
| Zawartość chlorku sodu | % | <=0,015 | 0,015 |
| CuSO4 · 5H2O → CuSO4 + 5H2O |
| (MCuSO4·5H2O = 249,5 g/mol, MCuSO4 = 159,5 g/mol, MH2O = 18,0 g/mol) |
| A. | 1. wyżarzyć ezę, 2. obrócić szalkę, 3. ponownie nanosić drobnoustroje, zahaczając przynajmniej raz o wcześniejszą ścieżkę. |
| B. | 1. nie wyżarzać ezy, 2. obrócić szalkę, 3. ponownie nanosić drobnoustroje, zahaczając przynajmniej raz o wcześniejszą ścieżkę. |
| C. | 1. wyżarzyć ezę, 2. obrócić szalkę, 3. ponownie nanosić drobnoustroje, nie zahaczając ani razu o wcześniejszą ścieżkę. |
| D. | 1. wyżarzyć ezę, 2. pozostawić szalkę w tym samym miejscu, 3. ponownie nanosić drobnoustroje, zahaczając przynajmniej raz o wcześniejszą ścieżkę. |

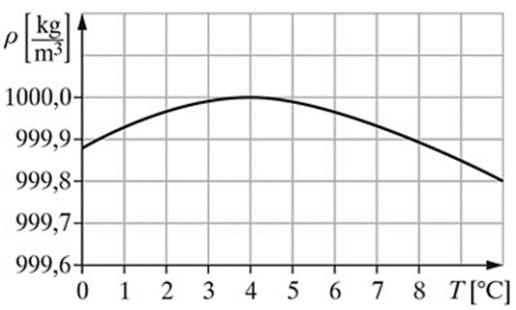
| Umieść probówki w adapterach. Zawsze umieszczaj probówki symetrycznie celem prawidłowego wyważenia rotora. W przypadku użycia tylko jednej probówki niezbędne jest umieszczenie przeciwwagi po stronie przeciwnej. Po zamknięciu pokrywy zostaje ona automatycznie zablokowana ... |
| 1 mval/dm3 – 2,8°dH (stopni niemieckich) |

| − fiolet krystaliczny, 2-3 minuty, |
| − płyn Lugola, 1-2 minuty, |
| − alkohol aż do odbarwienia, ok. 30 sekund, |
| − woda – spłukanie, |
| − fuksyna w roztworze fenolowym (rozcieńczenie1:10), 20 sekund, |
| − woda – spłukanie |
| Procedura otrzymywania tlenku magnezu przez prażenie węglanu magnezu. Odważoną ilość węglanu magnezu ubić dokładnie w tyglu (wcześniej zważonym) i przykryć pokrywką. Początkowo ogrzewać niewielkim kopcącym płomieniem, a następnie gdy tygiel ogrzeje się, ogrzewać silniej w temperaturze czerwonego żaru przez około 20 minut. Po zakończeniu prażenia tygiel odstawić do ostudzenia chroniąc przed wilgocią. Zważyć tygiel z preparatem i obliczyć wydajność. |