Filtrowanie pytań
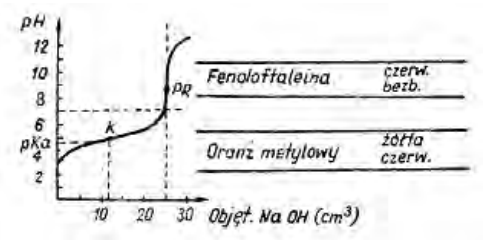
Zamieszczony wykres przedstawia krzywą miareczkowania
Aby uzyskać wodorotlenek wapnia, odważono 30 g węglanu wapnia, który następnie wyprażono. Powstały tlenek wapnia dodano do 100 cm3 wody, a otrzymany osad wysuszono i zważono, uzyskując 18,5 g wodorotlenku wapnia. Jaką wydajność miała ta reakcja?
Ca – 40 g/mol; O – 16 g/mol; C – 12 g/mol; H – 1 g/mol
Gdzie należy przechowywać cyjanek potasu KCN?
Instalacja, do której należy podłączyć palnik, powinna być pokryta farbą w kolorze
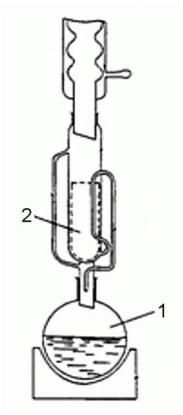
W celu przeprowadzenia oznaczenia za pomocą aparatu przedstawionego na ilustracji surowiec roślinny umieszcza się w
Najskuteczniejszą techniką separacji ketonu oraz kwasu karboksylowego obecnych w roztworze benzenowym jest
Naważkę NaOH o masie 0,0400 g rozpuścić w małej ilości wody, a następnie przelać ten roztwór do kolby miarowej o pojemności 500 cm3 i uzupełnić kolbę miarową wodą do tzw. kreski. Masa molowa NaOH wynosi 40,0 g/mol. Jakie jest stężenie molowe przygotowanego roztworu?
Do analizy pobrano próbkę o masie 200 mg. Na podstawie informacji zamieszczonych w tabeli określ, w jakiej skali będzie wykonana ta analiza.
| Wielkość próbki | Skala analizy |
|---|---|
| > 0,1 g | makro |
| 0,01 – 0,1 g | semimikro |
| 0,0001 – 0,01 g | mikro |
| < 10-4 g | ultramikro |
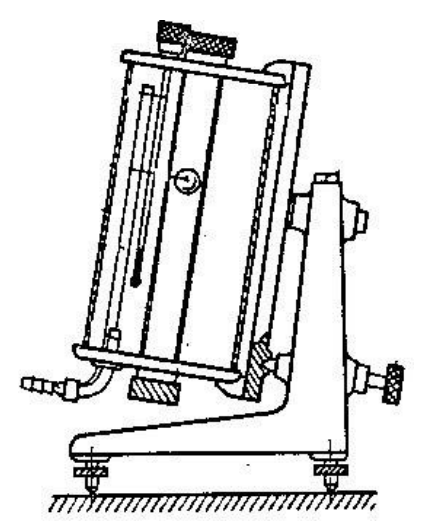
Na rysunku przedstawiono lepkościomierz
Opis w ramce przedstawia sposób oczyszczania substancji poprzez
| Próbke substancji stałej należy umieścić w kolbie kulistej, zaopatrzonej w chłodnicę zwrotną, dodać rozpuszczalnika - etanolu i delikatnie ogrzewać do wrzenia. Po lekkim ostudzeniu dodać do roztworu niewielką ilość węgla aktywnego, zagotować i przesączyć na gorąco. Przesącz pozostawić do ostygnięcia, a wydzielony osad odsączyć pod zmniejszonym ciśnieniem, przemyć niewielką ilością rozpuszczalnika, przenieść na szalkę, pozostawić do wyschnięcia, a następnie zważyć. |
Jaką metodą określa się stężenie cukrów redukujących w produktach owocowych?
Aby przeprowadzać ręczną obróbkę szkła w laboratorium, konieczne jest posiadanie okularów ochronnych oraz rękawic.
Oblicz masę wapienia, który został rozłożony, jeśli w trakcie reakcji uzyskano 44,8 dm3 CO2 (w warunkach standardowych).
MC = 12 g/mol, MCa = 40 g/mol, MO = 16 g/mol
Podstawowy zestaw do filtracji składa się ze statywu oraz
Przedstawiony schemat ideowy ilustruje proces syntezy z propanu C3H8 → C3H7Cl → C3H6 → C3H6(OH)2 → C3H5(OH)2Cl → C3H5(OH)3
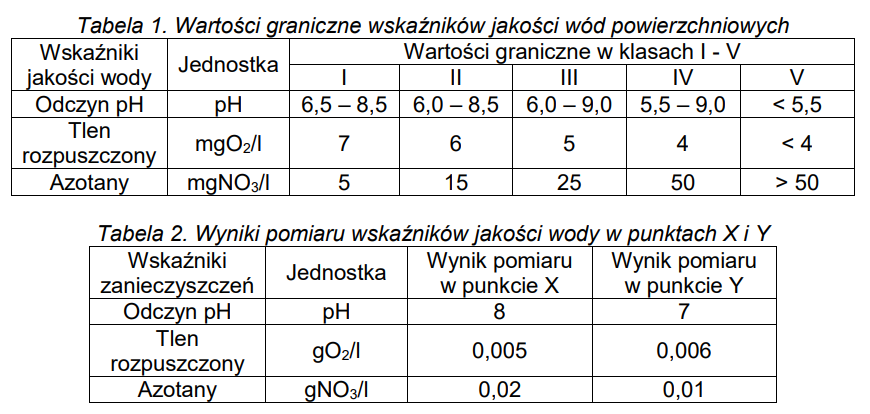
Na podstawie danych w tabelach 1-2 zawierających wartości graniczne wskaźników jakości wody i uzyskane wyniki pomiarowe oceń jakość wody w punktach pomiarowych X i Y, określając jej klasę.
W wodzie poddawanej procesowi dezynfekcji mierzy się zawartość chloru wolnego. Co oznacza ten parametr?
W trakcie kalibracji stężenia roztworu kwasu solnego na przynajmniej przygotowany roztwór zasady sodowej ma miejsce reakcja
W którym wierszu tabeli podano ilości substancji i wody, potrzebne do sporządzenia 350 g roztworu o stężeniu 7%?
| Masa substancji | Masa wody | |
|---|---|---|
| A. | 24,5 g | 350 g |
| B. | 24,5 g | 325,5 g |
| C. | 7 g | 343 g |
| D. | 7 g | 350 g |
Obecność jasnofioletowego zabarwienia płomienia palnika podczas analiz chemicznych wskazuje na obecność w roztworze jonów
Najwyżej czyste odczynniki chemiczne to odczynniki
Podczas reakcji chlorku żelaza(III) z wodorotlenkiem potasu dochodzi do wytrącenia wodorotlenku żelaza(III) w formie
W makroanalizie wykorzystuje się próbki o ciężarze
Jaka była zawartość jonów żelaza (II) w oznaczanym roztworze, jeżeli na jego zmiareczkowanie zużyto \( 10 \, \text{cm}^3 \) roztworu \( \text{KMnO}_4 \) o stężeniu \( 0{,}02 \, \text{mol/dm}^3 \)?
Wzór do obliczeń:
$$ m_{Fe} = 5 \cdot c_{mol} \cdot V \cdot M_{Fe} $$
gdzie: \( V \) – objętość roztworu \( \text{KMnO}_4 \) zużyta w czasie miareczkowania [\( \text{dm}^3 \)], \( M_{Fe} = 56 \, \text{g/mol} \), \( c_{mol} \) – stężenie molowe roztworu \( \text{KMnO}_4 \) [\( \text{mol/dm}^3 \)]
Dostanie się do środowiska bakterii Salmonella, które były hodowane na pożywkach mikrobiologicznych, może skutkować
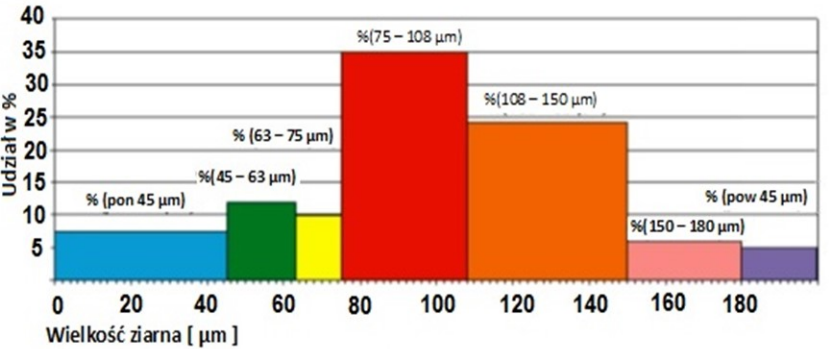
Na diagramie słupkowym przedstawiono wyniki analizy sitowej surowca w formie proszkowej. W jakiej kolejności zamontowano sita w wytrząsarce, licząc je od naczynia zbierającego?
Jaką metodą dokonuje się oceny intensywności koloru karmelu?
Ustalenie wartości miana roztworu wodorotlenku sodu na wodoroftalan potasu jest rekomendowane przez IUPAC, ponieważ wodoroftalan potasu jest substancją
Wyznacz refrakcję molową (Rm) dla kwasu octowego korzystając z danych zawartych w tabeli.
Rm = ∑a ∙ Ra gdzie: a – liczba atomów jednego rodzaju, Ra – refrakcja atomowa

Metodą, którą można oznaczyć całkowitą zawartość siarki w paliwach stałych, jest
W tabeli przedstawiono wartości iloczynów rozpuszczalności wybranych siarczanów(VI).
| CaSO4 | 6,1·10-5 |
| SrSO4 | 2,8·10-7 |
| BaSO4 | 1,1·10-10 |
| PbSO4 | 2,2·10-8 |
Po dodaniu roztworu kwasu siarkowego(VI) do roztworu zawierającego Ca2+, Sr2+, Ba2+, Pb2+ jako pierwszy wytrąci się osad
Proces, w wyniku którego formy wegetatywne mikroorganizmów ulegają zniszczeniu (pozostają jedynie bakterie w postaci spor oraz tzw. wolne wirusy), nazywany jest
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |
Jakie jest przeznaczenie próby jodowej, m.in. w produkcji piwa?
Aby wykonać roztwór mosiądzu (stop miedzi), jaki kwas należy zastosować?
Wartości iloczynów rozpuszczalności związków srebra wynoszą odpowiednio: Osad której soli srebra wytrąci się jako pierwszy podczas dodawania jonów Ag+ do roztworu zawierającego jony I-, Br-, Cl- oraz CN-?
| Związek chemiczny | Iloczyn rozpuszczalności |
|---|---|
| AgCl | 1,8·10-10 |
| AgBr | 5,3·10-13 |
| AgCN | 1,4·10-16 |
| AgI | 8,3·10-17 |
Przeprowadzono reakcję 13 g cynku z kwasem solnym zgodnie z równaniem: Zn + 2 HCl → ZnCl2 + H2↑. Otrzymano 1,12 dm3 wodoru (w warunkach normalnych). Masy molowe to: MZn = 65 g/mol, MH = 1g/mol, MCl = 35,5g/mol. Jaka jest wydajność tego procesu?
Zamieszczona instrukcja dotyczy wykonania preparatu mikroskopowego
| 1. Materiał nanieść na szkiełko podstawowe. 2. Po wyschnięciu, preparat utrwalić przez przeciągnięcie szkiełka podstawowego nad płomieniem palnika spirytusowego. 3. Następnie nanieść na szkiełko roztwór błękitu metylenowego i pozostawić do wyschnięcia. 4. Spłukać wodą destylowaną, pozostawić preparat do wyschnięcia. |