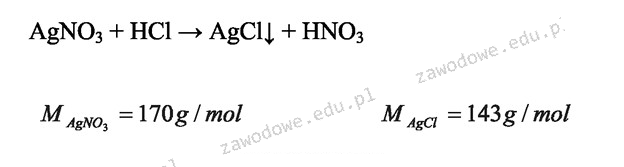Odpowiedź 70% jest poprawna, ponieważ obliczenia wydajności procentowej reakcji opierają się na zrozumieniu podstawowych zasad chemii analitycznej. W tym przypadku, najpierw obliczamy liczbę moli azotanu(V) srebra (AgNO3) z danej masy, korzystając z jego masy molowej (169,87 g/mol). Z 17,00 g AgNO3 otrzymujemy 0,100 moli. Reakcja między azotanem srebra a kwasem solnym (HCl) prowadzi do powstania chlorku srebra (AgCl) i azotanu sodu. Stosunek stechiometryczny wynosi 1:1, co oznacza, że 0,100 moli AgNO3 powinno dać 0,100 moli AgCl. Obliczając teoretyczną masę chlorku srebra (m=0,100 mol * 143,32 g/mol), otrzymujemy 14,33 g. Wydajność procentowa obliczana jest jako (masa uzyskana/mnica teoretyczna) * 100%, co w tym przypadku daje (10,01 g / 14,33 g) * 100% = 69,8%, co zaokrągla się do 70%. Taki sposób obliczania wydajności reakcji jest standardową praktyką w chemii analitycznej, szczególnie w laboratoriach zajmujących się syntezami chemicznymi.
Typowe błędy w szacowaniu wydajności reakcji chemicznych często wynikają z niepełnego zrozumienia stechiometrii reakcji, co prowadzi do błędnych obliczeń. W przypadku reakcji między azotanem(V) srebra a kwasem solnym, każdy z reagentów ma swoją rolę, a ich proporcje muszą być ściśle przestrzegane. Odpowiedzi, które wskazują na wydajności 60%, 50% lub 100%, wynikają z mylnych założeń dotyczących mas molowych, niewłaściwego rozumienia reakcji lub błędnych obliczeń. Na przykład, jeżeli ktoś obliczałby wydajność na podstawie błędnej masy teoretycznej chlorku srebra, mógłby uzyskać wyniki, które nie odzwierciedlają rzeczywistego przebiegu reakcji. Z kolei oszacowanie wydajności na 100% sugeruje, że cała teoretyczna masa została uzyskana, co w praktyce laboratoriach chemicznych jest rzadkością z powodu strat materiałowych, niepełnej reakcji lub obecności zanieczyszczeń. Przykłady takie jak nieodpowiednie mieszanie reagentów czy nieprzestrzeganie warunków reakcji mogą również prowadzić do obniżonej wydajności. Dlatego tak ważne jest, aby przy obliczaniu wydajności procentowej operować dokładnymi wartościami i mieć świadomość praktycznych ograniczeń chemicznych, co przyczynia się do uzyskania wiarygodnych wyników w badaniach i syntezach chemicznych.