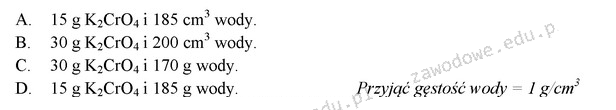Odpowiedź C jest prawidłowa, ponieważ stanowi właściwe obliczenie masy substancji potrzebnej do przygotowania roztworu chromianu(VI) potasu o stężeniu 15% (m/m). Stężenie m/m oznacza, że 15% masy roztworu to masa rozpuszczonej substancji. W przypadku 200 g roztworu, aby uzyskać 15%, należy obliczyć, ile masy substancji przypada na ten roztwór. Zgodnie z równaniem: 200 g * 0,15 = 30 g chromianu(VI) potasu. Reszta masy roztworu to woda, która wynosi 200 g - 30 g = 170 g. Praktycznie, w laboratoriach chemicznych, precyzyjne przygotowanie roztworów o określonym stężeniu jest kluczowe, zwłaszcza w analizach chemicznych, gdzie niewłaściwe stężenie może prowadzić do błędnych wyników analiz. Dobre praktyki w laboratoriach podkreślają znaczenie dokładności w przygotowywaniu roztworów, co powinno być realizowane poprzez użycie odpowiednich wag analitycznych oraz procedur kalibracji.
Wybór innej odpowiedzi prowadzi do błędnych wniosków dotyczących obliczeń stężenia roztworu. Wiele osób może pomylić pojęcie stężenia procentowego z innymi rodzajami stężenia, co skutkuje niewłaściwymi obliczeniami. Na przykład, niektórzy mogą sądzić, że 15% stężenie oznacza, że dla 200 g roztworu potrzebna jest inna masa substancji, co jest mylnym podejściem. Kiedy obliczamy stężenie m/m, musimy brać pod uwagę całkowitą masę roztworu, a nie tylko masę rozpuszczalnika. Kluczowym błędem myślowym jest także nieuznawanie, że masa rozpuszczalnika (tj. wody) jest odzwierciedleniem różnicy pomiędzy masą roztworu a masą substancji. Prawidłowe podejście do obliczeń stężenia wymaga zrozumienia, jak roztwory są przygotowywane oraz jak proporcje wpływają na ich właściwości. W praktyce chemicznej, takie błędy mogą prowadzić do nieprecyzyjnych wyników badań, co w końcu może wpłynąć na jakość produktów w przemyśle chemicznym. Dlatego kluczowe jest, aby mieć solidne podstawy w matematycznych aspektach chemii oraz przestrzegać standardów laboratoryjnych, aby uniknąć takich pomyłek.