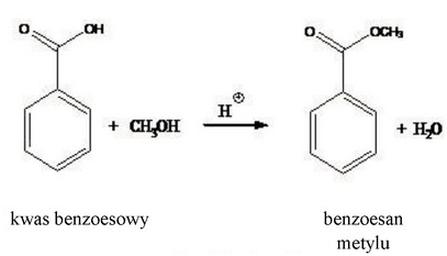
Aby zrozumieć, dlaczego 153,9 g benzoesanu metylu to prawidłowa odpowiedź, warto przyjrzeć się całemu procesowi estryfikacji. Zaczynamy od obliczenia liczby moli kwasu benzoesowego. Przy masie 150 g i masie molowej 122,12 g/mol, otrzymujemy około 1,228 moli. W procesach chemicznych, takich jak estryfikacja, często przyjmuje się stechiometrię reakcji 1:1, co oznacza, że 1 mol kwasu benzoesowego reaguje z 1 molem alkoholu do produkcji 1 mola estry. Teoretyczna masa produktu, którą można by uzyskać, oblicza się na podstawie moli i masy molowej benzoesanu metylu, co daje nam około 167,3 g. Jednak w rzeczywistości nie każda reakcja przebiega w 100% wydajności. W przypadku omawianej reakcji wydajność wynosi 92%, co oznacza, że otrzymany produkt to nie cała teoretyczna masa, a jej 92%. Obliczenie rzeczywistej masy benzoesanu metylu poprzez pomnożenie 167,3 g przez 0,92 prowadzi do uzyskania 153,9 g. Taka analiza nie tylko podkreśla znaczenie dokładnych obliczeń w chemii, ale także ilustruje podstawowe zasady prowadzenia reakcji chemicznych w warunkach laboratoryjnych, co jest kluczowe w różnych zastosowaniach przemysłowych, takich jak produkcja estrowych dodatków do żywności czy kosmetyków.
Analizując niepoprawne odpowiedzi, zauważamy, że najczęściej popełniane błędy dotyczą nieprawidłowego obliczenia wydajności reakcji oraz mylnego zrozumienia stechiometrii. W chemii estryfikacji, kluczowe jest zrozumienie, że moli kwasu benzoesowego nie można bezpośrednio przeliczyć na masę produktu bez uwzględnienia wydajności. Osoby, które wybrały inne odpowiedzi, mogły popełnić błąd przy obliczaniu teoretycznej masy produktu lub zignorować wydajność reakcji. Na przykład, 167,3 g stanowi masę teoretyczną, ale nie uwzględnia wydajności 92%, co prowadzi do zawyżenia rezultatów. Przyjęcie, że cała masa teoretyczna to masa uzyskana w reakcji, jest klasycznym błędem, który można łatwo popełnić, jeśli nie zrozumie się praktycznych aspektów prowadzenia reakcji chemicznych. W laboratoriach chemicznych ważne jest nie tylko dążenie do jak największej wydajności, ale także poprawne oszacowanie rzeczywistych wyników, co ma kluczowe znaczenie w przemyśle farmaceutycznym i chemicznym, gdzie kontrola jakości i efektywność procesów są na wagę złota. Dlatego zawsze należy dokładnie analizować wszystkie dane wejściowe i wyjściowe, co pozwala na uzyskanie rzetelnych wyników oraz zrozumienie mechanizmów rządzących danym procesem chemicznym.