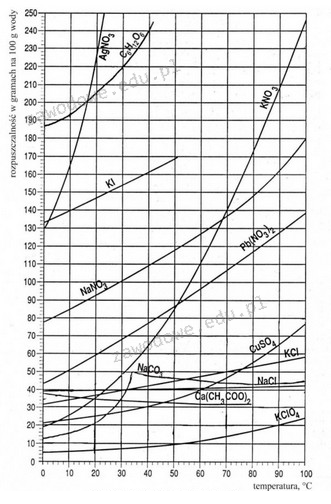
Odpowiedź 225 g jest poprawna, ponieważ przy przygotowywaniu roztworu nasyconego jodku potasu w temperaturze 25°C, istotne jest odczytanie wartości jego rozpuszczalności z wykresu. W przypadku jodku potasu, rozpuszczalność wynosi około 1500 g na 1000 g wody. Z tej wartości można obliczyć ilość jodku potasu potrzebną do rozpuszczenia w 150 g wody. Obliczenia są następujące: 150 g wody * (1500 g KJ na 1000 g wody) = 225 g KJ. Takie podejście pozwala na uzyskanie roztworu nasyconego, co jest kluczowe w wielu procesach chemicznych, takich jak synteza chemiczna, gdzie kontrolowane stężenia reagentów są niezbędne. Umiejętność pracy z wykresami rozpuszczalności jest fundamentalna w laboratoriach chemicznych i jest szeroko stosowana w przemysłach farmaceutycznych oraz chemicznych, gdzie precyzyjne przygotowanie roztworów jest kluczowe dla jakości produktów.
Wybrałeś jedną z niepoprawnych odpowiedzi, co może wynikać z nieznajomości zasad dotyczących rozpuszczalności substancji w wodzie. W przypadku jodku potasu, kluczowe jest zrozumienie, że każdy związek chemiczny ma określoną rozpuszczalność, która zmienia się w zależności od temperatury. Odpowiedzi, które wskazują na wyższe wartości, mogą sugerować nadmierne założenie, że więcej substancji zawsze prowadzi do większego stężenia roztworu. W rzeczywistości, w przypadku roztworów nasyconych, istnieje górny limit, który nie może być przekroczony, co oznacza, że dodawanie dodatkowych gramów substancji nie spowoduje dalszego rozpuszczenia, a jedynie pozostanie w formie osadu. Typowym błędem jest niedocenienie wartości rozpuszczalności, co prowadzi do mylnych wniosków o potrzebnej ilości substancji. Kluczową umiejętnością w chemii jest umiejętność analizy i wykorzystania danych dotyczących rozpuszczalności, co jest istotne w aplikacjach naukowych i przemysłowych. Zrozumienie tego zagadnienia jest niezbędne do właściwego przygotowywania roztworów oraz prowadzenia eksperymentów chemicznych, a także do bezpiecznego i efektywnego projektowania procesów chemicznych.