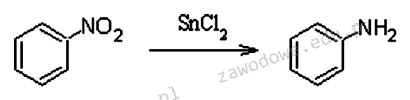
Poprawna odpowiedź to 124 g nitrobenzenu, co wynika z przeprowadzenia obliczeń uwzględniających wydajność procesu oraz stosunki molowe reagentów. Aby uzyskać 80 g aniliny, musimy wziąć pod uwagę, że proces reakcji ma wydajność 85%. To oznacza, że nie cała ilość nitrobenzenu przekształci się w anilinę. Z pierwszej reakcji chemicznej wynika, że 1 mol nitrobenzenu daje 1 mol aniliny. Masy molowe tych substancji to odpowiednio 123 g/mol dla nitrobenzenu i 93 g/mol dla aniliny. Stąd, aby uzyskać 80 g aniliny, obliczamy potrzebną ilość nitrobenzenu, stosując wzór: m_nitrobenzenu = (m_aniliny / wydajność) * (M_nitrobenzenu / M_aniliny). Po podstawieniu wartości, uzyskujemy 124 g. W praktyce proces ten jest istotny w przemyśle chemicznym, gdzie dokładność w obliczeniach reagentów jest kluczowa dla efektywności produkcji i oszczędności surowców.
Wybór odpowiedzi innej niż 124 g nitrobenzenu wskazuje na zrozumienie, które nie uwzględnia kluczowych zasad związanych z wydajnością reakcji chemicznych oraz stosunkami molowymi reagentów. Wiele osób może błędnie zakładać, że do uzyskania 80 g aniliny wystarczy wziąć tę samą masę nitrobenzenu, co aniliny, co wprowadza w błąd. W procesie chemicznym bardzo istotne jest zrozumienie, że nie wszystkie reagenty przekształcają się w produkt końcowy z powodu strat, niepełnych reakcji czy innych czynników. W tym przypadku, aby uzyskać 80 g aniliny przy 85% wydajności, należy obliczyć ilość nitrobenzenu, uwzględniając, że z 124 g nitrobenzenu uzyskamy jedynie 85% tego, co teoretycznie moglibyśmy uzyskać. Wybierając zbyt małą ilość nitrobenzenu, np. 80 g, użytkownik nie bierze pod uwagę, że wymagana początkowa masa reagentu powinna być większa, aby kompensować straty w procesie. Ponadto, niepoprawne odpowiedzi mogą wynikać z mylnego przekonania, że stężenie reagentów nie ma wpływu na końcowy wynik. W rzeczywistości w chemii analitycznej i procesowej, precyzyjne obliczenia mają fundamentalne znaczenie, a zrozumienie wydajności reakcji jest kluczowym elementem skutecznego projektowania procesów chemicznych.