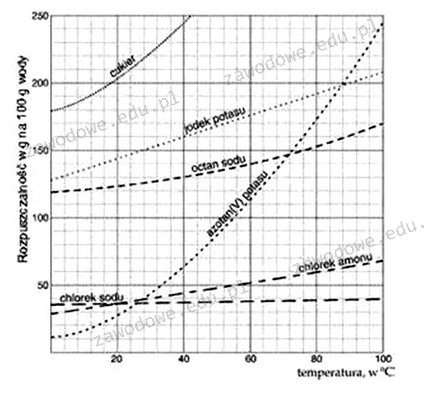
Poprawna odpowiedź to 20°C, ponieważ wykres przedstawiający rozpuszczalność azotanu(V) potasu w wodzie wskazuje, że przy tej temperaturze 20 g tej soli może być rozpuszczone w 100 g wody, co oznacza, że roztwór nagle osiąga stan nasycenia. W praktyce, rozumienie stanu nasycenia jest kluczowe w wielu dziedzinach chemii, zwłaszcza w procesach takich jak krystalizacja czy przygotowanie roztworów. Na przykład, w przemyśle chemicznym, gdzie precyzyjne stężenia substancji są niezbędne do uzyskania wysokiej jakości produktów, znajomość temperatury nasycenia pozwala na optymalizację procesów. Ponadto, w laboratoriach analitycznych, gdzie badane są różne substancje chemiczne, umiejętność oceny stanu nasycenia roztworu jest istotna dla zapewnienia dokładności pomiarów. Dlatego też, zrozumienie tego zagadnienia jest podstawą nie tylko w teorii, ale i w praktycznych zastosowaniach chemicznych.
Wybierając odpowiedzi 6°C, 8°C lub 40°C, można napotkać kilka powszechnych błędów myślowych oraz nieporozumień związanych z rozpuszczalnością substancji chemicznych. Odpowiedzi te sugerują, że w niższej lub znacznie wyższej temperaturze roztwór azotanu(V) potasu mógłby osiągnąć stan nasycenia, co jest niezgodne z danymi przedstawionymi na wykresie. Przy 6°C i 8°C, stężenie rozpuszczonych cząsteczek nie osiąga 20 g na 100 g wody, co oznacza, że roztwór w tych temperaturach jest nienasycony. W praktyce, takie podejście może prowadzić do błędnych wniosków w procesach laboratoryjnych czy przemysłowych, gdzie dokładne stężenie jest kluczowe. Wybór 40°C sugeruje, że wydaje się, że wyższe temperatury mogą zwiększyć rozpuszczalność, co w przypadku azotanu(V) potasu jest błędne w tym kontekście, gdyż w wyższych temperaturach roztwór może osiągnąć inny poziom nasycenia. W rzeczywistości, wiele soli ma swoje unikalne krzywe rozpuszczalności, które wskazują, że każda substancja ma różne właściwości w zależności od temperatury. Dlatego ważne jest, aby korzystać z wykresów i danych naukowych, aby podejmować świadome decyzje w laboratoriach czy przemyśle chemicznym, unikając opartych na przypuszczeniach wniosków dotyczących rozpuszczalności substancji.