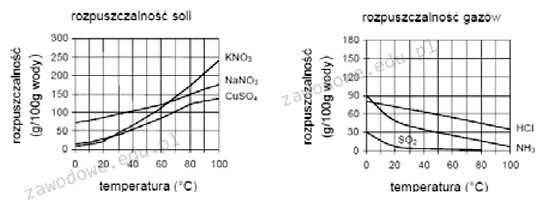
CuSO4, czyli siarczan miedzi(II), charakteryzuje się szczególną cechą zwiększania rozpuszczalności w wyższych temperaturach, co jest zgodne z ogólnymi zasadami chemii dotyczącej soli. Wzrost temperatury od 40°C do 60°C znacząco wpływa na rozpuszczalność CuSO4, co można zaobserwować na wykresach rozpuszczalności. Ta właściwość jest istotna w kontekście wielu zastosowań przemysłowych, takich jak w procesie oczyszczania wody, gdzie odpowiednia rozpuszczalność soli wpływa na efektywność usuwania zanieczyszczeń. Dodatkowo, zrozumienie wpływu temperatury na rozpuszczalność różnych substancji jest kluczowe w laboratoriach chemicznych, gdzie prowadzi się syntezę związków chemicznych. Wiedza ta może pomóc także w optymalizacji procesów produkcyjnych w przemyśle chemicznym, co jest zgodne z najlepszymi praktykami inżynieryjnymi. Z tego powodu odpowiedź na pytanie jest nie tylko teoretycznie istotna, ale także ma praktyczne zastosowanie w różnych dziedzinach.
Wybór odpowiedzi innych niż CuSO4, takie jak NH3, HCl czy NaNO3, może wynikać z niewłaściwego zrozumienia zasad dotyczących rozpuszczalności soli w kontekście zmiany temperatury. NH3, czyli amoniak, to gaz, którego rozpuszczalność w wodzie wzrasta przy niższych temperaturach, co stoi w sprzeczności z koncepcją wzrostu rozpuszczalności przy wyższej temperaturze. HCl jako kwas również nie wykazuje tego samego zachowania w zakresie temperatur, ponieważ jego rozpuszczalność jest na ogół stabilna i nie zmienia się w tym zakresie znacząco. NaNO3, sól sodowa kwasu azotowego, również wykazuje zwiększoną rozpuszczalność w wyższych temperaturach, jednak nie w takim stopniu jak CuSO4. Zrozumienie, że różne substancje mają różne profile rozpuszczalności w funkcji temperatury, jest kluczowe dla chemików i inżynierów chemicznych. Typowe błędy myślowe związane z interpretacją wykresów rozpuszczalności mogą prowadzić do niedoszacowania lub przeszacowania rzeczywistych właściwości substancji, co jest krytyczne w wielu zastosowaniach przemysłowych. Dlatego znajomość zachowania soli w różnych temperaturach jest niezbędna do efektywnego projektowania procesów chemicznych oraz ich optymalizacji.