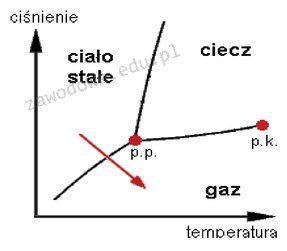
Sublimacja to proces, w którym substancja przechodzi bezpośrednio z fazy stałej do gazowej, omijając fazę ciekłą. W kontekście wykresu fazowego na którym zaznaczono strzałką proces sublimacji, można zauważyć, że zmiana stanu skupienia zachodzi przy odpowiednich warunkach ciśnienia i temperatury. Przykładem sublimacji jest suchy lód (stały dwutlenek węgla), który przechodzi w gaz bez przechodzenia w fazę ciekłą. W przemyśle, sublimacja jest wykorzystywana m.in. w procesach suszenia, gdzie materiały mogą stracić wilgoć w formie pary bez przechodzenia przez stan ciekły, co jest bardziej efektywne energetycznie. Zrozumienie procesu sublimacji ma zastosowanie w wielu dziedzinach, od chemii po inżynierię materiałową, gdzie kontrolowanie stanów skupienia jest kluczowe dla właściwości finalnego produktu. Ważne jest także, aby zrozumieć różnicę między sublimacją a innymi procesami fazowymi, takimi jak parowanie, które zachodzi tylko w fazie ciekłej, czy topnienie, które polega na przejściu z fazy stałej do ciekłej. Takie zrozumienie jest istotne dla prawidłowego interpretowania wykresów fazowych oraz przewidywania zachowań substancji w różnych warunkach.
Wybór odpowiedzi, która wskazuje na proces resublimacji, topnienia lub parowania, jest wynikiem nieporozumienia dotyczącego procesów zmiany stanów skupienia substancji. Resublimacja jest procesem odwrotnym do sublimacji, polegającym na przejściu z fazy gazowej do stałej. W kontekście wykresu fazowego, który ilustruje zjawisko sublimacji, nie możemy mówić o resublimacji, ponieważ strzałka na wykresie wskazuje bezpośrednie przejście z fazy stałej do gazowej. Z kolei, topnienie to proces, w którym substancja w stanie stałym przekształca się w ciecz, co również nie jest zgodne z przedstawionym na wykresie zjawiskiem. Topnienie zachodzi pod wpływem podniesienia temperatury, co zmienia strukturalne właściwości substancji, ale nie zachodzi bezpośrednio w gaz. Parowanie, z drugiej strony, to proces, w którym cząsteczki cieczy przechodzą w stan gazowy, co również jest różne od sublimacji. Wybierając jedną z tych opcji, można błędnie zinterpretować charakterystykę zmiany faz, co może prowadzić do nieprawidłowych wyników w eksperymentach oraz analizach chemicznych. Zrozumienie tych różnic jest kluczowe dla nauk przyrodniczych i inżynieryjnych, gdzie precyzyjne opisy procesów fizycznych i chemicznych są fundamentem skutecznych aplikacji oraz badań.