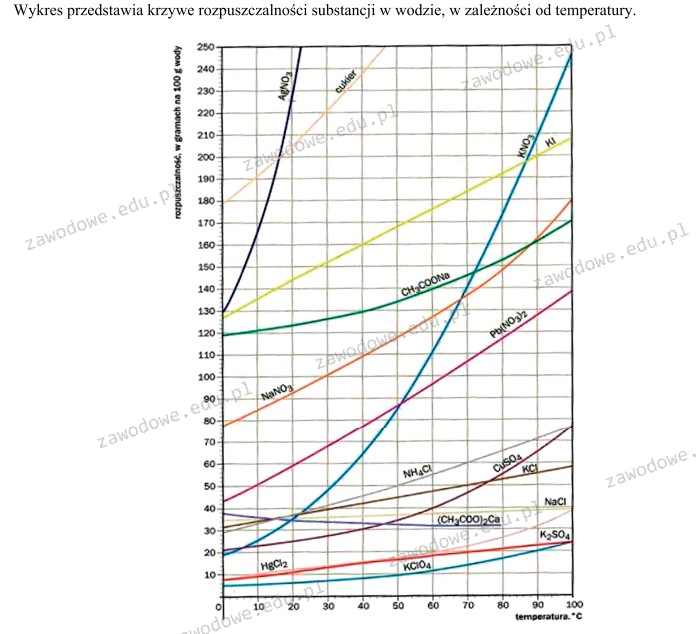
KClO4, czyli perchloran potasu, jest najsłabiej rozpuszczalną substancją przedstawioną na wykresie, co wynika z analizy krzywych rozpuszczalności. W porównaniu do innych substancji, takich jak AgNO3, KNO3 i KI, jego linia znajduje się najniżej, co oznacza, że nawet w wyższych temperaturach jego rozpuszczalność pozostaje minimalna. W praktyce, niska rozpuszczalność KClO4 ma istotne znaczenie w różnych zastosowaniach chemicznych, szczególnie w laboratoriach analitycznych oraz w procesach przemysłowych, gdzie kontrola nad stężeniem reagentów jest kluczowa. W budownictwie chemicznym i syntezach organicznych, substancje o niskiej rozpuszczalności mogą być używane jako reagenty do tworzenia bardziej skomplikowanych związków, dzięki czemu KClO4 jest istotnym komponentem w badaniach nad reakcjami chemicznymi. Znajomość zachowania substancji w różnych warunkach temperaturowych jest również zgodna z najlepszymi praktykami w dziedzinie chemii i inżynierii materiałowej, co pozwala na optymalizację procesów technologicznych.
Wybór AgNO3, KI lub KNO3 jako najbardziej rozpuszczalnej substancji obrazuje typowe nieporozumienia dotyczące rozpuszczalności soli w wodzie. AgNO3, będący azotatem srebra, jest powszechnie znany ze swojej stosunkowo wysokiej rozpuszczalności, szczególnie w temperaturze pokojowej. Jednak w kontekście wykresu, jego linia rozpuszczalności znajduje się wyżej niż KClO4, co oznacza, że ma wyższą rozpuszczalność w wodzie. Podobnie, KI, jodek potasu, jest znany z tego, że dobrze rozpuszcza się w wodzie, co czyni go niewłaściwym wyborem w tym kontekście. KNO3, czyli azotan potasu, również ma znaczną rozpuszczalność, zwłaszcza w podwyższonych temperaturach. Nieprawidłowe wybory mogą wynikać z intuicyjnych, ale błędnych założeń, że sole o dużych ładunkach i złożonych strukturach zawsze będą mniej rozpuszczalne. W rzeczywistości, to nie tylko struktura chemiczna, ale także interakcje między cząsteczkami rozpuszczalnika a solutem wpływają na rozpuszczalność. Dlatego kluczowe jest zrozumienie równowagi między siłami przyciągającymi a odpychającymi w roztworach. Te błędy myślowe mogą prowadzić do nieporozumień, które mają wpływ na praktykę laboratoryjną oraz przemysłową, gdzie precyzyjna znajomość rozpuszczalności reagentów jest kluczowa dla przeprowadzania właściwych reakcji chemicznych.