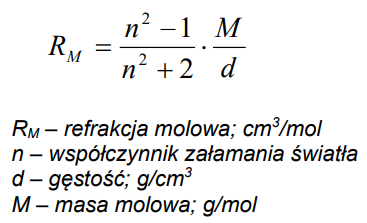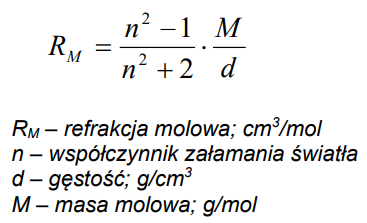Kwas octowy, jako substancja chemiczna o znanym współczynniku załamania oraz gęstości, pozwala na obliczenie refrakcji molowej przy użyciu wzoru: R = (n - 1) * M / d, gdzie n to współczynnik załamania, M to masa molowa, a d to gęstość. Podstawiając wartości: n = 1,3874, M = 60,054 g/mol oraz d = 1,0498 g/cm³, obliczenia prowadzą do wyniku refrakcji molowej wynoszącej około 13,48 cm³/mol. Taki wynik jest istotny w kontekście zastosowań chemicznych, ponieważ refrakcja molowa dostarcza informacji o interakcji substancji z falami świetlnymi, co jest kluczowe w optyce oraz w przemyśle farmaceutycznym przy projektowaniu leków. Dobrą praktyką jest jednak nie tylko wykonywanie obliczeń, ale także ich weryfikacja w kontekście literatury fachowej i standardów branżowych, co pozwala na uzyskanie wiarygodnych wyników w badaniach naukowych i zastosowaniach praktycznych.
Wybór błędnej odpowiedzi na pytanie dotyczące refrakcji molowej kwasu octowego może wynikać z niepełnego zrozumienia wzoru obliczeniowego. W przypadku obliczania refrakcji molowej, kluczowymi parametrami są współczynnik załamania światła, masa molowa oraz gęstość substancji. Niezrozumienie relacji między tymi zmiennymi może prowadzić do błędnych obliczeń. Przykład błędnych myślenia to pomylenie jednostek miary bądź niepoprawne podstawienie wartości do wzoru. Na przykład, niektórzy mogą założyć, że większa gęstość automatycznie prowadzi do wyższej refrakcji, co jest fałszywe. W rzeczywistości, wyższy współczynnik załamania może kompensować mniejszą gęstość, prowadząc do niższej refrakcji molowej. Ponadto, ignorowanie praktycznych aspektów zastosowania tych obliczeń, takich jak ich znaczenie w analizie chemicznej, może zniekształcić zrozumienie. Zrozumienie, że refrakcja molowa ma fundamentalne znaczenie w chemii analitycznej oraz przemysłowej, może pomóc uniknąć typowych pułapek myślowych. Warto również zapoznać się z normami i standardami branżowymi, które mogą dostarczyć dodatkowych wskazówek odnośnie prawidłowego podejścia do takich obliczeń.