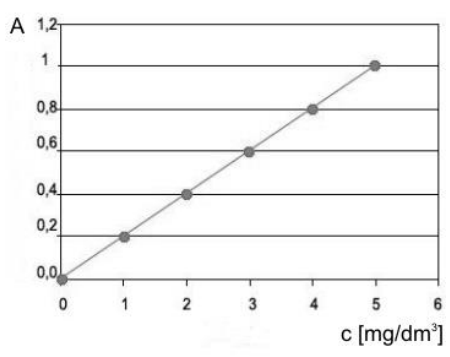
Odpowiedź 3 mg/dm3 jest poprawna, ponieważ dobrze odzwierciedla zależność pomiędzy absorbancją a stężeniem substancji w roztworze. Zgodnie z zasadami spektrofotometrii, kiedy analizujemy próbki, absorbancja (A) związana jest ze stężeniem (c) na podstawie równania Beer-Lamberta: A = ε * c * l, gdzie ε to współczynnik absorbcji molowej, a l to długość drogi optycznej. W tym przypadku, wykorzystując krzywą wzorcową, możemy wizualnie porównać zmierzoną absorbancję z wartościami stężenia. Wysoka precyzja tej metody sprawia, że jest szeroko stosowana w laboratoriach chemicznych do określania stężenia substancji w roztworze, co ma kluczowe znaczenie w analizach jakościowych i ilościowych. Przykładem może być analiza próbek wody, gdzie monitorowanie stężenia zanieczyszczeń jest istotne dla ochrony środowiska. Dobrze skonstruowana krzywa wzorcowa zapewnia wiarygodność wyników, co jest zgodne z zasadami dobrej praktyki laboratoryjnej i normami ISO.
Odpowiedzi, które wskazują na stężenia 5 mg/dm3, 2 mg/dm3 oraz 4 mg/dm3, są błędne i wynikają z niepoprawnego zrozumienia analizy spektrofotometrycznej. W przypadku pomiaru absorbancji ważne jest zrozumienie, że każde stężenie substancji w roztworze powinno być interpretowane w kontekście krzywej wzorcowej, która ilustruje zależność absorbancji od stężenia. Przykładowo, wybierając stężenie 5 mg/dm3, można błędnie założyć, że wyższa absorbancja automatycznie odpowiada wyższemu stężeniu, co jest mylnym podejściem, ponieważ każda krzywa wzorcowa może mieć inną charakterystykę w zależności od badanego związku. Wybór 2 mg/dm3 i 4 mg/dm3 może wynikać z nadinterpretacji danych lub błędnego odczytu na wykresie. Często w praktyce laboratoryjnej popełniane są błędy w kalibracji spektrofotometrów, co prowadzi do niepoprawnych odczytów. Ważne jest, aby pamiętać, że odczyty muszą być dokładnie weryfikowane i porównywane z wcześniej ustaloną krzywą, aby zapewnić wiarygodność wyników. Niezrozumienie zasady działania krzywej wzorcowej oraz nieścisłości w odczycie mogą prowadzić do poważnych błędów interpretacyjnych, co podkreśla znaczenie odpowiednich praktyk laboratoryjnych i skrupulatności w analizach chemicznych.