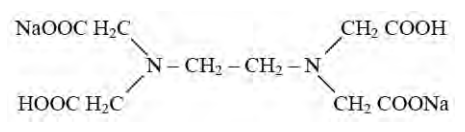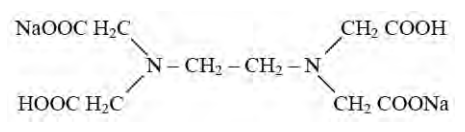Odpowiedź "kompleksometrycznego" jest poprawna, ponieważ miareczkowanie kompleksometryczne wykorzystuje związki chelatujące, takie jak EDTA, do kompleksowania metali. Kwas etylenodiaminotetraoctowy (EDTA) jest jednym z najczęściej stosowanych reagentów w tej metodzie. Umożliwia precyzyjne oznaczanie stężeń jonów metali w roztworze poprzez tworzenie stabilnych kompleksów. W praktycznych zastosowaniach, takich jak analiza wody, kontrola jakości żywności czy w medycynie, miareczkowanie kompleksometryczne pozwala na dokładne oznaczanie takich metali jak wapń, magnez czy ołów. W branży chemicznej oraz laboratoriach analitycznych, właściwe stosowanie tej techniki jest kluczowe dla uzyskania wiarygodnych wyników. Warto również zauważyć, że miareczkowanie kompleksometryczne jest zgodne z normami metodycznymi, takimi jak ISO 11885, co podkreśla jego znaczenie w standardowych procedurach analitycznych.
Wybierając odpowiedzi inne niż "kompleksometrycznego", można napotkać na typowe błędy analityczne związane z niepełnym zrozumieniem różnych metod miareczkowania. Alkalimetryczne miareczkowanie, na przykład, odnosi się do reakcji kwas-zasada, gdzie mierzona jest zmiana pH w roztworze. Tego typu miareczkowanie nie jest odpowiednie dla analizy metali, ponieważ nie korzysta z właściwości chelatujących, które są kluczowe w przypadku badania jonów metali. Z kolei miareczkowanie acydymetryczne również opiera się na reakcji kwas-zasada, co również nie ma zastosowania w przypadku analizy kompleksów metalowych. Natomiast miareczkowanie manganometryczne jest specyficzne dla oznaczania stężeń substancji redukujących za pomocą manganu, co również nie jest związane z chelatowaniem metali. Wybór niewłaściwych odpowiedzi często wynika z braku zrozumienia specyfiki każdej z tych metod i ich zastosowań. W praktyce, dokładne rozróżnienie tych technik jest niezbędne w laboratoriach analitycznych, aby uniknąć błędów w wynikach, które mogą prowadzić do niewłaściwych wniosków lub decyzji.