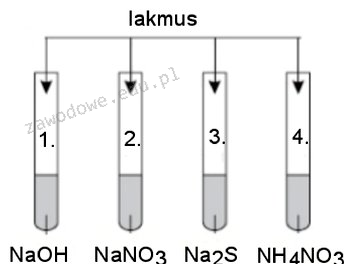
Lakmus zabarwi się na czerwono w probówce nr 4 ze względu na obecność azotanu amonu (NH4NO3), który w roztworze wodnym dysocjuje na jony NH4+ i NO3-. Jon amonowy NH4+ ma zdolność do reakcji z wodą, prowadząc do powstania słabego kwasu amonowego (NH4OH), co powoduje obniżenie pH roztworu i jego zakwaszenie. W praktyce, zjawisko to jest istotne w chemii analitycznej, gdzie kontrola pH jest kluczowa dla wielu reakcji chemicznych. Zastosowanie wskaźników pH, takich jak lakmus, jest powszechne w laboratoriach, aby szybko ocenić kwasowość lub zasadowość roztworów. Prawidłowe interpretowanie wyników testów pH pozwala na optymalizację warunków reakcji chemicznych oraz monitorowanie procesów biologicznych i środowiskowych, co jest zgodne z dobrymi praktykami laboratoryjnymi. Zrozumienie tych mechanizmów jest kluczowe dla chemików i biologów, a także dla osób zajmujących się ochroną środowiska, aby zapewnić bezpieczeństwo i skuteczność w różnych dziedzinach nauki.
Odpowiedzi, które wskazują na probówki nr 1, 2 lub 3, są błędne z kilku powodów. W probówce nr 1 nie znajduje się substancja, która mogłaby obniżyć pH, co sprawia, że lakmus nie zabarwi się na czerwono. W probówce 2, jeśli substancja nie jest kwasowa, nie wywoła zakwaszenia roztworu, co również skutkuje brakiem zmiany koloru lakmusu. Podobnie w probówce nr 3, gdzie brak kwasowego składnika również nie prowadzi do zmiany barwy wskaźnika. Często myli się wpływ różnych substancji chemicznych na pH roztworu, co prowadzi do nieprawidłowych wniosków. To merytoryczny błąd, ponieważ zrozumienie interakcji chemicznych jest kluczowe w każdej dziedzinie chemii. Niezrozumienie, jak różne jony i cząsteczki wpływają na kwasowość roztworu, może prowadzić do nieprawidłowej interpretacji wyników i wadliwych praktyk laboratoryjnych. Ważne jest, aby zwracać uwagę na właściwości chemiczne substancji oraz ich wpływ na środowisko roztworu, aby podejmować właściwe decyzje w kontekście badań chemicznych oraz analitycznych. W edukacji chemicznej, kluczowe jest kształtowanie umiejętności interpretacji wyników oraz zrozumienie znaczenia pH w kontekście reakcji chemicznych oraz ich aplikacji w praktyce.