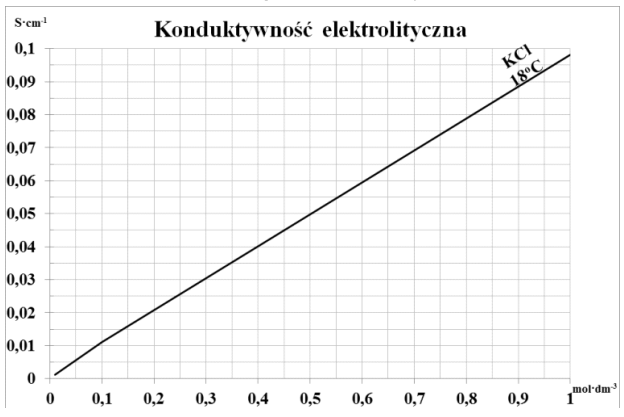
Odpowiedź 0,450 mol/dm3 to właściwy wybór. W chemii analitycznej wyznaczanie stężenia substancji na podstawie konduktywności to zupełnie normalna sprawa. Jeśli zrobiliśmy krzywą wzorcową z pomiarów konduktywności różnych roztworów, to możemy bez problemu odczytać stężenie próbki, z którą pracujemy. W przypadku chlorku potasu (KCl), to, że dobrze się rozpuszcza i dysocjuje na jony K+ i Cl-, powoduje, że konduktywność roztworu idzie w parze ze stężeniem. Jak spojrzysz na krzywą i zobaczysz wartość konduktywności 0,045 S∙cm-1, to łatwo dojdziesz do tego, że to odpowiada stężeniu 0,450 mol/dm3. Takie pomiary są mega ważne w laboratoriach chemicznych, bo precyzyjne określenie stężenia elektrolitów ma kluczowe znaczenie podczas różnych procesów, czy to w analizie jakości wody, czy w farmacji, gdzie stężenia substancji czynnych muszą być naprawdę dokładnie kontrolowane.
Patrząc na inne odpowiedzi, można zauważyć, że wybór 0,500 mol/dm3 jest skutkiem błędnego myślenia, że konduktywność roztworu zawsze jest bezpośrednio proporcjonalna do stężenia, co nie do końca jest prawdą, zwłaszcza w przypadku KCl. Przy wyższych stężeniach mogą wystąpić różne efekty związane z jonami, które sprawiają, że konduktywność może być mniejsza. Co do odpowiedzi 0,055 mol/dm3 i 0,045 mol/dm3, to myślę, że można się było pomylić przy odczycie z krzywej, bo te stężenia są zbyt niskie, żeby pasowały do podanej konduktywności 0,045 S∙cm-1. Taki błąd może wynikać z braku znajomości, jak działają krzywe wzorcowe i jak wpływają na pomiary. Często ludzie zapominają o kontekście, w jakim są robione pomiary i jakie mają właściwości substancje. W analizach chemicznych ważne jest, żeby nie tylko znać liczby, ale też rozumieć, co za nimi stoi, żeby nie popełniać podobnych błędów i mieć rzetelne wyniki.