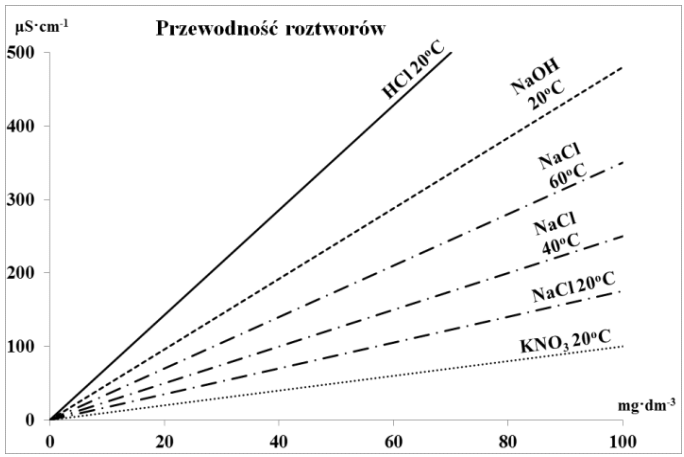
No więc, jak to jest, jak zwiększysz temperaturę, to przewodność elektrolityczna roztworu rośnie. To dlatego, że przy wyższej temperaturze cząsteczki poruszają się szybciej, co sprzyja ruchowi jonów. W praktyce oznacza to, że im cieplejszy roztwór, tym więcej jonów może się ruszać, a to zwiększa przewodność. Widziałem to w różnych procesach przemysłowych, gdzie temperatura jest naprawdę kluczowa, żeby wszystko działało jak należy. W laboratoriach też trzeba na to uważać, bo jak eksperymentujesz z roztworami, to temperatura może wpłynąć na wyniki. I nie zapominajmy, że są standardy, jak ISO 7888, które mówią o pomiarach w konkretnej temperaturze – to pokazuje, jak ważny jest ten aspekt w nauce i przemyśle.
Wybór opcji, która mówi, że przewodność roztworu rośnie, gdy temperatura spada, jest błędny. W rzeczywistości, kiedy obniżasz temperaturę, jony ruszają się wolniej, bo mają mniej energii kinetycznej. To w efekcie powoduje, że przewodność maleje – to jest coś, co można zaobserwować w wielu eksperymentach chemicznych. Odpowiedzi, które mówią, że przewodność nie zależy od stężenia jonów, też są mylące. Rzeczywistość jest taka, że większe stężenie jonów zwykle wiąże się z wyższą przewodnością. Różne jony wpływają na przewodność inaczej, bo mają różne ładunki i wielkości. Na przykład, jony sodu zachowują się inaczej niż jony potasu. Dlatego, żeby dobrze zrozumieć przewodność roztworów elektrolitycznych, musisz brać pod uwagę stężenie, rodzaj jonów i temperaturę. To jest kluczowe w różnych dziedzinach, od chemii analitycznej po inżynierię chemiczną.