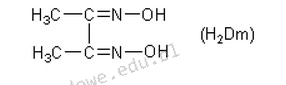Poprawna odpowiedź to nikiel, ponieważ wzór przedstawiony na zdjęciu dotyczy dimetyloglioksymu (H2Dm), który jest standardowym reagentem wykorzystywanym w analityce chemicznej do wagowego oznaczania niklu. Dimetyloglioksym reaguje z jonami niklu, tworząc czerwony kompleks, który jest trudno rozpuszczalny w wodzie, co umożliwia jego efektywne wytrącenie i zważenie. Taki sposób analizy jest szeroko stosowany w przemyśle metalurgicznym oraz w laboratoriach zajmujących się badaniami jakości materiałów. Proces ten opiera się na precyzyjnych pomiarach masy i stężenia, co jest zgodne z dobrymi praktykami w analityce chemicznej, takimi jak stosowanie standardów odniesienia oraz procedur kalibracji. Zrozumienie tego procesu jest kluczowe dla chemików analitycznych, którzy muszą być świadomi, jak różne czynniki mogą wpływać na wyniki analizy, a także jakie metody można zastosować do minimalizacji błędów eksperymentalnych.
Wybór innych odpowiedzi, takich jak bar, siarczany(VI) czy magnez, wskazuje na brak zrozumienia zastosowań dimetyloglioksymu w analizie chemicznej. Bar nie jest związkiem, który reagowałby z dimetyloglioksymem w taki sposób, aby wytrącić kompleks widoczny w postaci czerwonego osadu. Siarczany(VI) również nie wchodzą w reakcję z dimetyloglioksymem, ponieważ ich chemiczne właściwości nie sprzyjają tworzeniu nierozpuszczalnych kompleksów, które można by zważono. Magnez, mimo że jest metalem, również nie jest oznaczany tą metodą, a jego analizy wymagają innych podejść, np. spektroskopii czy chromatografii. Typowe błędy myślowe, które mogą prowadzić do takich nieprawidłowych wyborów, obejmują nieprawidłowe skojarzenia chemiczne oraz brak znajomości specyfiki reakcji chemicznych. Ważne jest, aby mieć świadomość, że każdy z tych związków chemicznych ma swoją unikalną charakterystykę i właściwości, które determinują ich użyteczność w konkretnej metodzie analizy. Zrozumienie tych różnic jest kluczowe, aby poprawnie interpretuować wyniki analityczne oraz stosować odpowiednie metody w praktyce laboratywnej.