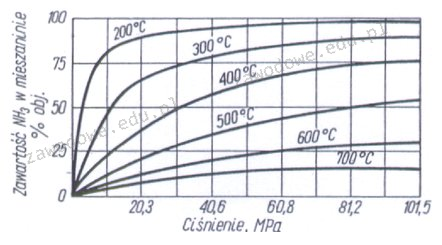
Odpowiedź 30,4 MPa jest prawidłowa, ponieważ w procesie syntezy amoniaku ciśnienie odgrywa kluczową rolę w osiąganiu wysokiej wydajności reakcji. Przy temperaturze 200°C, aby uzyskać 90% zawartość NH3 w mieszaninie, musimy zastosować ciśnienie, które zgodnie z analizą wykresu wynosi około 30,4 MPa. Wysokie ciśnienie sprzyja przesunięciu równowagi reakcji zgodnie z zasadą Le Chateliera, co prowadzi do zwiększenia ilości produktów reakcji, w tym przypadku amoniaku. W praktyce, procesy przemysłowe, takie jak Haber-Bosch, stosują podobne parametry, co potwierdza, że ciśnienia rzędu 30 MPa są standardem w produkcji amoniaku. Dobrze dobrane warunki syntezy są kluczowe z punktu widzenia ekonomiczności procesu oraz efektywności energetycznej. Wysoka zawartość NH3 pozwala na opłacalność produkcji oraz minimalizację kosztów operacyjnych, dlatego tak istotne jest prawidłowe zrozumienie wpływu ciśnienia na tę reakcję.
Odpowiedzi 60,8 MPa, 10,2 MPa oraz 91,3 MPa są nieprawidłowe z różnych powodów, które wynikają z niepełnego zrozumienia zasad termodynamiki i równowagi reakcji chemicznych. Wyższe ciśnienia, takie jak 60,8 MPa czy 91,3 MPa, mogą wydawać się na pierwszy rzut oka korzystne, ponieważ zwiększają tempo reakcji, jednak w praktyce mogą prowadzić do nieefektywności. Wysokie ciśnienie może powodować niepożądane reakcje uboczne oraz zwiększać ryzyko uszkodzenia aparatury, co wiąże się z dodatkowymi kosztami. Z kolei zbyt niskie ciśnienie, takie jak 10,2 MPa, nie jest wystarczające do przesunięcia równowagi reakcji w kierunku produktów, co skutkuje niską wydajnością syntezy amoniaku. W przemyśle chemicznym, zgodnie z zasadą Le Chateliera, konieczne jest utrzymywanie odpowiednich parametrów, aby proces był opłacalny. Stosowanie nieodpowiednich ciśnień może prowadzić do nieefektywności i strat surowców, co podkreśla znaczenie precyzyjnego doboru warunków reakcji oraz ich zgodności z wymaganiami technologicznymi i ekonomicznymi w przemyśle chemicznym.