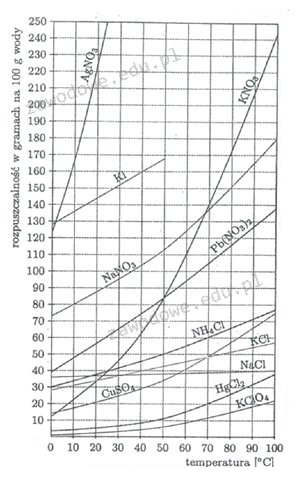
Odpowiedź NH4Cl jest prawidłowa, ponieważ zgodnie z danymi na wykresie rozpuszczalności, amoniowy chlorek (NH4Cl) w temperaturze 50°C ma rozpuszczalność wynoszącą około 50 g na 100 g wody. W związku z tym, w 500 g wody można by rozpuścić do 250 g NH4Cl, co dokładnie odpowiada przedstawionym w pytaniu danym. Analizując inne związki chemiczne, takie jak Pb(NO3)2 czy KNO3, zauważamy, że ich rozpuszczalność w tej temperaturze jest znacznie wyższa, co wyklucza je jako odpowiedzi. Przykładowo, KNO3 ma rozpuszczalność przekraczającą 100 g na 100 g wody przy 50°C. Prawidłowe zrozumienie rozpuszczalności różnych substancji chemicznych jest istotne w laboratoriach chemicznych i w przemyśle, gdzie precyzyjne stosowanie substancji w roztworach może wpływać na wyniki badań i produkcji.
Wybór jakiejkolwiek innej opcji nie jest poprawny, ponieważ każda z nich ma inną charakterystykę rozpuszczalności, co prowadzi do błędnych wniosków. Pb(NO3)2, znany jako azotan ołowiu(II), ma znacznie wyższą rozpuszczalność w wodzie, osiągając wartości powyżej 100 g na 100 g wody w temperaturze 50°C. KNO3, czyli azotan potasu, również wykazuje wysoką rozpuszczalność, która w tym przypadku zwiększa się wraz z temperaturą, co sprawia, że nie możliwe jest uzyskanie nasyconego roztworu z 250 g substancji w 500 g wody. Z kolei KI, czyli jodek potasu, charakteryzuje się jeszcze wyższą rozpuszczalnością, co sprawia, że również nie odpowiada przedstawionym warunkom. Typowe błędy myślowe, które prowadzą do wyboru tych związków, można przypisać ogólnemu zrozumieniu rozpuszczalności chemicznej i nie zwracaniu uwagi na konkretne wartości podane w pytaniu. Ważne jest, aby przy pracy z roztworami chemicznymi korzystać z wykresów rozpuszczalności, które dostarczają istotnych informacji na temat konkretnego zachowania substancji w różnych warunkach. Dobrą praktyką jest także ciągłe sprawdzanie i weryfikowanie danych dotyczących rozpuszczalności w aktualnych źródłach, co może zapobiec nieporozumieniom oraz błędom w eksperymentach chemicznych.