Pytanie 1
Jeżeli partia towaru składa się z 10 dużych opakowań, wtedy z jednego opakowania pobiera się kilka próbek, które następnie łączy, uzyskując próbkę
Wynik: 26/40 punktów (65,0%)
Wymagane minimum: 20 punktów (50%)
Jeżeli partia towaru składa się z 10 dużych opakowań, wtedy z jednego opakowania pobiera się kilka próbek, które następnie łączy, uzyskując próbkę
Średnia masa wody wypływająca z pipety o deklarowanej pojemności 25 cm3, w temperaturze 25°C wynosi 24,80 g. Korzystając z danych zamieszczonych w tabeli wskaż wartość poprawki kalibracyjnej dla tej pipety.
| Masa wody zajmującej objętość 1 dm3 w zależności od temperatury pomiaru | |
|---|---|
| Temperatura °C | Masa wody g |
| 20 | 997,17 |
| 21 | 997,00 |
| 22 | 996,80 |
| 23 | 996,59 |
| 24 | 996,38 |
| 25 | 996,16 |
| 26 | 995,93 |
| 27 | 995,69 |
| 28 | 995,45 |
| 29 | 995,18 |
| 30 | 994,92 |
Rozpuszczalniki organiczne powinny być składowane
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Miesięczne zapotrzebowanie laboratorium analitycznego na 2-propanol wynosi 500 cm3. Na jak długo wystarczy ta substancja?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wybierz spośród wymienionych właściwości tę, która nie dotyczy naczyń kwarcowych.
Jaką masę chlorku sodu można znaleźć w 150 g roztworu soli o stężeniu 5% (m/m)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie jest pH 0,001-molowego roztworu NaOH?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który z poniższych sposobów homogenizacji próbki jest najbardziej odpowiedni do przygotowania próbki gleby do analizy chemicznej?
Przedstawiony schemat ideowy ilustruje proces syntezy z propanu C3H8 → C3H7Cl → C3H6 → C3H6(OH)2 → C3H5(OH)2Cl → C3H5(OH)3
Sód metaliczny powinien być przechowywany w laboratorium
Proces przesiewania próbki prowadzi się za pomocą urządzenia przedstawionego na rysunku
| Tabela. Sposoby utrwalania próbek wody i ścieków, miejsce analizy, dopuszczalny czas przechowywania próbek | ||||
|---|---|---|---|---|
| Oznaczany parametr | Rodzaj naczynia do przechowywania próbki | Sposób utrwalania próbki | Miejsce wykonania analizy | Dopuszczalny czas przechowywania próbki |
| Chlorki | szklane lub polietylenowe | - | laboratorium | 96 godzin |
| Chlor pozostały | szklane | - | w miejscu pobrania próbki | - |
| ChZT | szklane | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 24 godziny |
| Kwasowość | szklane lub polietylenowe | schłodzenie do temperatury 2-5°C | laboratorium | 4 godziny |
| Mangan | szklane lub polietylenowe | zakwaszenie do pH<2, schłodzenie do temperatury 2-5°C | laboratorium | 48 godzin |
Jaką próbkę stanowi woreczek gleby pobranej zgodnie z instrukcją?
| Instrukcja pobierania próbek glebowych | |
| Próbki pierwotne pobiera się laską glebową z wierzchniej warstwy gleby 0-20 cm, kolejno wykonując czynności: – w miejscu pobierania próbki pierwotnej (pojedynczej), rolę świeżo zaoraną przydeptać, – pionowo ustawić laskę do powierzchni gleby, – wcisnąć laskę do oporu (na wysokość poprzeczki ograniczającej), – wykonać pełny obrót i wyjąć laskę, – zawartość wgłębienia (zasobnika) przenieść do pojemnika skrobaczki. Po pobraniu próbek pojedynczych, całość wymieszać i napełnić kartonik lub woreczek. | |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką substancję należy koniecznie oddać do utylizacji?
Jednym z sposobów oddzielania jednorodnych mieszanin jest
Z 250 g benzenu (M = 78 g/mol) uzyskano 350 g nitrobenzenu (M = 123 g/mol). Jaka jest wydajność reakcji nitrowania?
Próbka wzorcowa to próbka
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przygotować roztwór wzorcowy potrzebny do oznaczania miana, konieczne jest użycie odczynnika chemicznego o czystości przynajmniej
Jakim kolorem oznacza się instalację gazową w laboratorium analitycznym?
Wybór lokalizacji do poboru próbek wody z rzeki nie jest uzależniony od
W trzech probówkach umieszczono roztwory: wodorotlenku sodu, chlorku sodu i kwasu octowego. W celu identyfikacji zbadano ich odczyn za pomocą uniwersalnego papierka wskaźnikowego, a następnie fenoloftaleiny. Barwy wskaźników w badanych roztworach przedstawiono w tabeli:
| Wskaźnik | Barwa wskaźnika | ||
|---|---|---|---|
| próbówka nr 1 | próbówka nr 2 | próbówka nr 3 | |
| uniwersalny papierek wskaźnikowy | żółty | czerwony | niebieski |
| fenoloftaleina | bezbarwny | bezbarwny | malinowa |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Którą substancję można bezpośrednio wyrzucić do odpadów komunalnych?
Do narzędzi pomiarowych zalicza się
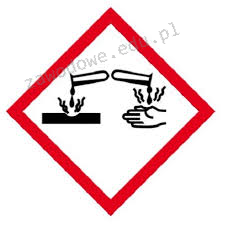
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Które spośród substancji wymienionych w tabeli pozwolą pochłonąć wydzielający się tlenek węgla(IV)?
| I | II | III | IV | V |
|---|---|---|---|---|
| Ca(OH)2(aq) | NaOH(s) | HNO3(stęż) | CuO(s) | CaO(s) |
Reakcja miedzi metalicznej z stężonym kwasem azotowym(V) prowadzi do powstania azotanu(V) miedzi(II) oraz jakiego związku?
Próbka, której celem jest ustalenie poziomu składników, dla których oznaczenia przygotowane przez różne laboratoria są niezgodne, to próbka