Pytanie 1
Piktogram nie jest konieczny dla
Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Piktogram nie jest konieczny dla
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
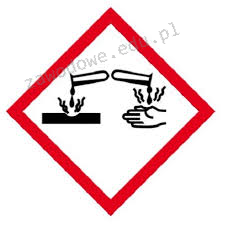
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Technika kwartowania (ćwiartkowania) pozwala na redukcję masy próbki ogólnej
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W chemicznym laboratorium apteczka pierwszej pomocy powinna zawierać
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Które spośród substancji wymienionych w tabeli pozwolą pochłonąć wydzielający się tlenek węgla(IV)?
| I | II | III | IV | V |
|---|---|---|---|---|
| Ca(OH)2(aq) | NaOH(s) | HNO3(stęż) | CuO(s) | CaO(s) |
Aby przygotować 250 cm3 0,2-molowego roztworu wodorotlenku sodu, należy odważyć
| MNaOH = 40g / mol |
Podczas pomiaru masy substancji w naczyniu wagowym na wadze technicznej, dla zrównoważenia ciężaru na szalce umieszczono odważniki: 20 g, 2 g, 500 mg, 200 mg, 20 mg, 10 mg, 10 mg oraz 5 g. Całkowita masa substancji z naczynkiem wyniosła
Gęstość próbki cieczy wyznacza się przy użyciu
Proces oddzielania składników jednorodnej mieszaniny, polegający na eliminacji jednego lub większej ilości składników z roztworu lub substancji stałej przy użyciu odpowiednio wybranego rozpuszczalnika, to
Dekantacja to metoda
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na podstawie danych zawartych w tabeli wskaż, który dodatek należy zastosować, w celu konserwacji próbek wody przeznaczonych do oznaczania jej twardości.
| Tabela. Techniki konserwacji próbek wody | |
|---|---|
| Stosowany dodatek lub technika | Rodzaje próbek, do których dodatek lub technika jest stosowana |
| Kwas siarkowy(VI) | zawierające węgiel organiczny, oleje lub tłuszcze, przeznaczone do oznaczania ChZT, zawierające aminy lub amoniak |
| Kwas azotowy(V) | zawierające związki metali |
| Wodorotlenek sodu | zawierające lotne kwasy organiczne lub cyjanki |
| Chlorek rtęci(II) | zawierające biodegradowalne związki organiczne oraz różne formy azotu i fosforu |
| Chłodzenie w temperaturze 4°C | zawierające mikroorganizmy, barwę, zapach, organiczne formy węgla, azotu i fosforu, przeznaczone do określenia kwasowości, zasadowości oraz BZT |
Jakie urządzenie wykorzystuje się do określania lepkości płynów?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Które równanie przedstawia reakcję otrzymywania mydła?
| CH3COOH + NaOH →CH3COONa + H2O |
| 2 CH3COOH + Na2O →2 CH3COONa + H2O |
| 2 C2H5COOH + 2 Na →2 C2H5COONa + H2↑ |
| C17H35COOH + NaOH →C17H35COONa + H2O |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby odróżnić urządzenia w laboratorium chemicznym, rury do próżni maluje się w kolorze
Ogólna próbka, jednostkowa lub pierwotna powinna
Z kolby miarowej o pojemności 1 dm3, zawierającej roztwór HCl o stężeniu 0,1 mol/dm3, pobrano pipetą 2,5 cm3, a następnie przeniesiono do kolby miarowej o pojemności 20 cm3 i rozcieńczono wodą "do kreski" miarowej. Jakie stężenie ma otrzymany roztwór?
Jakie jest stężenie roztworu NaOH, który zawiera 4 g wodorotlenku sodu w 1 dm3 (masa molowa NaOH = 40 g/mol)?
Sączenie osadów kłaczkowatych odbywa się przy użyciu sączków
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie są zalecenia dotyczące postępowania z odpadowymi roztworami kwasów oraz zasad?
Do szklanych narzędzi laboratoryjnych wielomiarowych używanych w analizach ilościowych należy
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
Jakie środki ochronne należy zastosować podczas sporządzania 1M roztworu zasady sodowej ze stężonego roztworu NaOH, na opakowaniu którego widnieje oznaczenie S/36/37/39?
| Numer zwrotu S | Warunki bezpiecznego stosowania |
|---|---|
| S36 | Używać odpowiedniej odzieży ochronnej |
| S37 | Używać odpowiednich rękawic |
| S38 | W przypadku niewystarczającej wentylacji używać sprzętu do oddychania |
| S39 | Używać okularów lub maski ochronnej |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Substancje pomocnicze wykorzystywane do realizacji podstawowych analiz jakościowych i ilościowych, które nie wymagają wysokiej czystości, są oznaczane na opakowaniach symbolem
Na skutek krystalizacji 18 g kwasu benzoesowego uzyskano 8 g czystego produktu. Jaką wydajność miała ta krystalizacja?
Aby odcedzić galaretowaty osad, konieczne jest użycie sączka
Naczynia z roztworem kwasu siarkowego(VI) o dużym stężeniu nie powinny być pozostawiane otwarte nie tylko za względów bezpieczeństwa, ale także dlatego, że kwas
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?