Pytanie 1
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wynik: 24/40 punktów (60,0%)
Wymagane minimum: 20 punktów (50%)
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
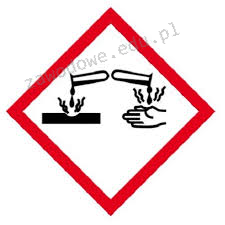
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Aby przeprowadzić syntezę substancji organicznej w temperaturze 150°C, należy zastosować łaźnię
Jakie proporcje objętościowe powinny być zastosowane do zmieszania roztworu etanolu o stężeniu 30% (V/V) z roztworem o stężeniu 70% (V/V), aby uzyskać roztwór o stężeniu 50% (V/V)?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Próbka, której celem jest ustalenie poziomu składników, dla których oznaczenia przygotowane przez różne laboratoria są niezgodne, to próbka
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Oblicz, jaką ilość węglanu sodu w gramach należy przygotować, aby uzyskać 500 cm3 roztworu tej soli o stężeniu 0,1000 mol/dm3.
MNa = 23 g/mol, MC = 12 g/mol, MO = 16 g/mol
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Próbka pobrana z próbki ogólnej, która odzwierciedla cechy partii produktu, określa się jako próbka
Analiza technicznego kwasu solnego dała następujące wyniki: 30% HCl, 0,008% H2SO4, 0,04% Fe.
Korzystając z zamieszczonej tabeli wymagań, określ gatunek kwasu, pamiętając, że decyduje o nim najgorszy wskaźnik.
| Wymagania chemiczne dotyczące kwasu siarkowego | ||||
| Wymagania | Gatunki | |||
| I | II | III | IV | |
| Chlorowodór, % | > 33 | > 29 | > 28 | > 27 |
| Kwas siarkowy(VI) w przel. na SO42-, % | < 0,009 | < 0,5 | < 1,6 | < 1,8 |
| Żelazo (Fe3+), % | < 0,005 | < 0,03 | < 0,03 | < 0,05 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W wyniku analizy sitowej próbki stałej otrzymano frakcję o średnicy ziaren 12 – 30 mm. Jaką masę powinna mieć prawidłowo pobrana próbka pierwotna?
| Tabela. Wielkość próbki pierwotnej w zależności od wielkości ziarna | ||||
|---|---|---|---|---|
| Średnica ziaren lub kawałków [mm] | do 1 | 1 - 10 | 11 - 50 | ponad 50 |
| Pierwotna próbka (minimum) [g] | 100 | 200 | 1000 | 2500 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W trakcie reakcji estryfikacji opisanej równaniem CH3COOH + C2H5OH ↔ CH3COOC2H5 + H2O użyto molowego stosunku alkoholu do kwasu wynoszącego 1:10. W rezultacie tego
Miesięczne zapotrzebowanie laboratorium analitycznego na 2-propanol wynosi 500 cm3. Na jak długo wystarczy ta substancja?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na ilustracji oznaczono numery 1 i 4:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby przygotować 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3, jaką kolbę miarową o pojemności należy wykorzystać?
Eliminacja substancji organicznych z próbki poprzez jej spalenie nazywa się
Proces oddzielania składników jednorodnej mieszaniny, polegający na eliminacji jednego lub większej ilości składników z roztworu lub substancji stałej przy użyciu odpowiednio wybranego rozpuszczalnika, to
Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
Metoda przygotowania próbki do badania, która nie jest
Procedura przygotowania roztworu Zimmermana-Reinharda
70 g MnSO4·10H2O rozpuścić w 500 cm3 wody destylowanej, dodając ostrożnie 125 cm3 stężonego H2SO4 i 125 cm3 85% H3PO4, ciągle mieszając. Uzupełnić wodą destylowaną do objętości 1dm3.
Który zestaw ilości odczynników jest niezbędny do otrzymania 0,5 dm3 roztworu Zimmermana-Reinharda, zgodnie z podaną procedurą?
| MnSO4·10H2O [g] | Stężony H2SO4 [cm3] | 85% H3PO4 [cm3] | Woda destylowana [cm3] | |
|---|---|---|---|---|
| A. | 35 g | 62,5 cm3 | 62,5 cm3 | ok. 370 cm3 |
| B. | 35 g | 62,5 cm3 | 62,5 cm3 | ok. 420 cm3 |
| C. | 70 g | 125 cm3 | 125 cm3 | ok. 500 cm3 |
| D. | 70 g | 125 cm3 | 125 cm3 | ok. 800 cm3 |
Jakiego odczynnika chemicznego, oprócz Na2Cr2O7, należy użyć do sporządzenia mieszaniny chromowej do czyszczenia sprzętu szklarskiego w laboratorium?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Naważkę NaOH o masie 0,0400 g rozpuścić w małej ilości wody, a następnie przelać ten roztwór do kolby miarowej o pojemności 500 cm3 i uzupełnić kolbę miarową wodą do tzw. kreski. Masa molowa NaOH wynosi 40,0 g/mol. Jakie jest stężenie molowe przygotowanego roztworu?
Jakie procesy towarzyszy efekt egzotermiczny?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wybierz poprawny zapis jonowy spośród podanych reakcji, w których otrzymywany jest siarczan(VI) baru.
Jakie urządzenie wykorzystuje się do określania lepkości płynów?
Aby zebrać próbki gazów, wykorzystuje się
Aby zregenerować rozpuszczalnik organiczny, należy wykonać proces