Pytanie 1
Jakie jest stężenie procentowe roztworu HCl (M=36,46 g/mol) o gęstości 1,19 g/cm3 oraz stężeniu molowym 12 mol/dm3?
Wynik: 38/40 punktów (95,0%)
Wymagane minimum: 20 punktów (50%)
Jakie jest stężenie procentowe roztworu HCl (M=36,46 g/mol) o gęstości 1,19 g/cm3 oraz stężeniu molowym 12 mol/dm3?
Aby przygotować miano kwasu solnego, konieczne jest odważenie węglanu sodu o masie wynoszącej około 400 mg. Jaką precyzję powinna mieć waga używana do odważenia węglanu sodu?
Dekantacja to metoda
Jaka minimalna pojemność powinna mieć miarka, aby jednorazowo zmierzyć 60,0 cm3 wody?
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
Wskaź zestaw reagentów oraz przyrządów wymaganych do przygotowania 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3?
Transportuje się pobrane próbki wody do analiz fizykochemicznych
Ile gramów cukru trzeba dodać do 200 gramów wody o temperaturze 20°C, aby uzyskać roztwór nasycony?
Aby otrzymać 200 g roztworu siarczanu(VI) sodu o stężeniu 12%, należy wykorzystać
(Na – 23 g/mol; S – 32 g/mol; H – 1 g/mol; O – 16 g/mol)
Jednym z sposobów oddzielania jednorodnych mieszanin jest
Aby zregenerować rozpuszczalnik organiczny, należy wykonać proces
Wybór lokalizacji do poboru próbek wody z rzeki nie jest uzależniony od
Próbka, której celem jest ustalenie poziomu składników, dla których oznaczenia przygotowane przez różne laboratoria są niezgodne, to próbka
Naczynia miarowe, skalibrowane "na wlew" (IN) to:
Etykieta roztworu kwasu azotowego(V) o koncentracji 6 mol/dm3 powinna zawierać nazwę substancji oraz
Aby uzyskać całkowicie bezwodny Na2CO3, przeprowadzono prażenie 143 g Na2CO3·10H2O (M = 286 g/mol). Po upływie zalecanego czasu prażenia odnotowano utratę masy 90 g. W związku z tym prażenie należy
Próbka wzorcowa to próbka
Oblicz, ile moli gazu można zebrać w pipecie gazowej o pojemności 500 cm3, jeśli gaz będzie gromadzony w warunkach normalnych. (W normalnych warunkach jeden mol gazu ma objętość 22,4 dm3)
Waga przedstawiona na rysunku umożliwia ważenie substancji z dokładnością do

Laboratoryjny stół powinien być zaopatrzony w instalację gazową oraz
W laboratorium chemicznym przewody instalacji rurowych są oznaczane różnymi kolorami, zgodnie z obowiązującymi normami. Polska Norma PN-70 N-01270/30 określa kolor dla wody jako
W urządzeniu Soxhleta wykonuje się
Próbka, którą analizujemy, to bardzo rozcieńczony wodny roztwór soli nieorganicznych, który ma być poddany analizie. Proces, który można zastosować do zagęszczenia tego roztworu, to
Roztwory o ściśle określonym stężeniu, używane w analizach miareczkowych, nazywamy
Aby oszacować czystość MgCO3, poddano prażeniu próbkę o wadze 5 g tej soli aż do osiągnięcia stałej masy. W trakcie prażenia zachodzi reakcja:
MgCO3 → MgO + CO2 Całkowity ubytek masy wyniósł 2,38 g.
(Masy molowe reagentów to: MgCO3 – 84 g/mol, MgO – 40 g/mol, CO2 – 44 g/mol) Jaką czystość miała próbka węglanu magnezu?
Do pojemników na odpady stałe, które są przeznaczone do utylizacji, nie można wprowadzać bezpośrednio cyjanków oraz związków kompleksowych zawierających jony cyjankowe z powodu
Czułość bezwzględna wagi definiuje się jako
Do przechowywania zamrożonych próbek wody stosuje się naczynia wykonane
Jakim kolorem oznacza się instalację gazową w laboratorium analitycznym?
Po połączeniu 50 cm3 wody z 50 cm3 alkoholu etylowego, objętość otrzymanej mieszanki jest poniżej 100 cm3. Zjawisko to jest spowodowane
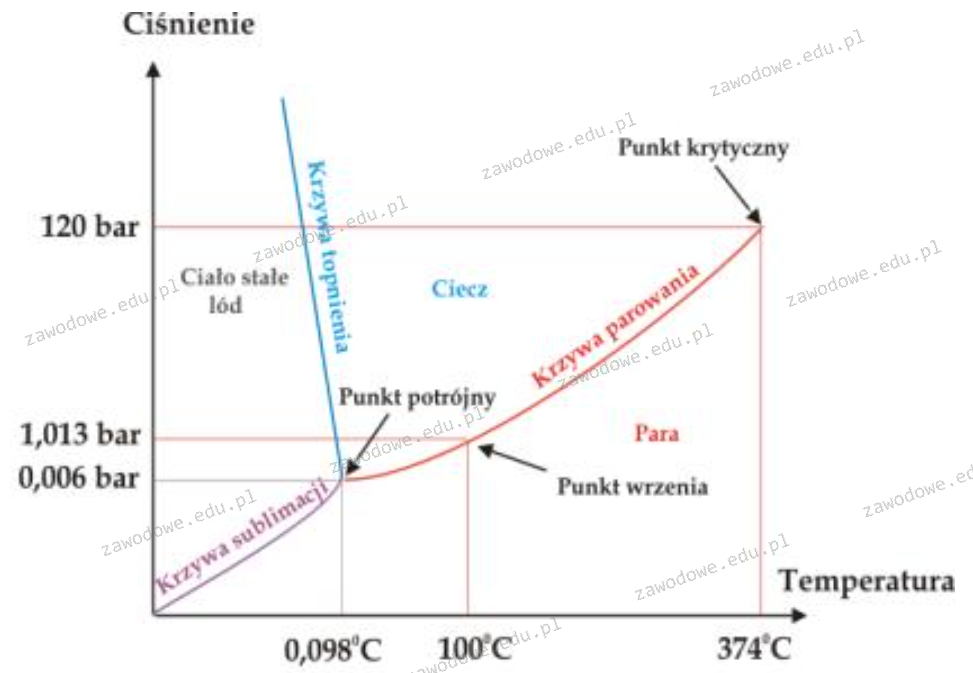
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Na podstawie informacji zawartej na pipecie, została ona skalibrowana na
Naczynia miarowe o kształcie rurek poszerzonych w środku, z wąskim i wydłużonym dolnym końcem, przeznaczone do pobierania i transportowania cieczy o ściśle określonej objętości, to
Chemikalia, dla których upłynął okres przydatności,
Roztwory, które wykorzystuje się do kalibracji pehametrów, to
Który zestaw zawiera niezbędne urządzenia laboratoryjne do przygotowania 10% (m/m) roztworu NaCl?
Zamieszczony piktogram przedstawia substancję o klasie i kategorii zagrożenia:

Średnia masa wody wypływająca z pipety o deklarowanej pojemności 25 cm3, w temperaturze 25°C wynosi 24,80 g. Korzystając z danych zamieszczonych w tabeli wskaż wartość poprawki kalibracyjnej dla tej pipety.
| Masa wody zajmującej objętość 1 dm3 w zależności od temperatury pomiaru | |
|---|---|
| Temperatura °C | Masa wody g |
| 20 | 997,17 |
| 21 | 997,00 |
| 22 | 996,80 |
| 23 | 996,59 |
| 24 | 996,38 |
| 25 | 996,16 |
| 26 | 995,93 |
| 27 | 995,69 |
| 28 | 995,45 |
| 29 | 995,18 |
| 30 | 994,92 |
Odważka analityczna wodorotlenku sodu, przygotowana fabrycznie, zawiera 0,1 mola NaOH. Jaką objętość wody destylowanej należy dodać w kolbie miarowej, aby uzyskać roztwór wodorotlenku sodu o stężeniu 0,0500 mol/dm3?
Ogólna próbka, jednostkowa lub pierwotna powinna