Pytanie 1
Wskaż definicję fiksanali?
Wynik: 4/40 punktów (10,0%)
Wymagane minimum: 20 punktów (50%)
Wskaż definicję fiksanali?
W trakcie kalibracji stężenia roztworu kwasu solnego na przynajmniej przygotowany roztwór zasady sodowej ma miejsce reakcja
Do 300 g wody o temperaturze 30oC dodano 120 g substancji, co zaowocowało powstaniem roztworu nasyconego. Jaką ma rozpuszczalność ta substancja w temperaturze 30oC?
Wykonano ocenę jakości dostarczonej partii wodorotlenku sodu.
Zgodne ze specyfikacją towaru są
| Parametr oznaczany | Jednostka | Wartość parametru | |
|---|---|---|---|
| Według specyfikacji | Zbadana analitycznie | ||
| Zawartość wodorotlenku sodu | % | >=98 | 98,3 |
| Zawartość węglanu sodu | % | <=0,4 | 0,39 |
| Zawartość chlorku sodu | % | <=0,015 | 0,015 |
Aby ustalić miano roztworu wodnego NaOH, należy zastosować
Proces usuwania substancji z cieczy lub wydobywania składnika z mieszanin cieczy, oparty na równowadze fazowej ciecz-gaz, nazywa się
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
W karcie charakterystyki pewnej substancji znajduje się piktogram dotyczący transportu. Jest to substancja z grupy szkodliwych dla zdrowia

W karcie charakterystyki chemikaliów znajduje się informacja o przechowywaniu dichromianu(VI) potasu: .. powinien być przechowywany w odpowiednio oznakowanych, szczelnie zamkniętych pojemnikach, w chłodnym, suchym i dobrze wentylowanym magazynie, który posiada instalację elektryczną i wentylacyjną. Z tego opisu wynika, że ten chemikal może być przechowywany
Brak odpowiedzi na to pytanie.
Podczas pomiaru masy substancji w naczyniu wagowym na wadze technicznej, dla zrównoważenia ciężaru na szalce umieszczono odważniki: 20 g, 2 g, 500 mg, 200 mg, 20 mg, 10 mg, 10 mg oraz 5 g. Całkowita masa substancji z naczynkiem wyniosła
Brak odpowiedzi na to pytanie.
Ile gramów 80% kwasu mrówkowego trzeba zważyć, aby uzyskać 200 g 20% roztworu tego kwasu?
Brak odpowiedzi na to pytanie.
Którą substancję można bezpośrednio wyrzucić do odpadów komunalnych?
Brak odpowiedzi na to pytanie.
Jakie roztwory chemiczne powinny być stanowczo pobierane przy włączonym dygestorium?
Brak odpowiedzi na to pytanie.
Jakim kolorem zazwyczaj oznacza się przewody w instalacji gazowej w laboratorium?
Brak odpowiedzi na to pytanie.
Stosunek masowy miedzi do siarki w siarczku miedzi(I) wynosi
| 16S Siarka 32 | 29Cu Miedź 63,55 |
Brak odpowiedzi na to pytanie.
Jakie są zalecenia dotyczące postępowania z odpadowymi roztworami kwasów oraz zasad?
Brak odpowiedzi na to pytanie.
W przypadku kontaktu ze stężonym roztworem zasady, co należy zrobić jak najszybciej?
Brak odpowiedzi na to pytanie.
Technika oddzielania płynnych mieszanin, w której wykorzystuje się różnice w prędkości migracji składników przez odpowiednią bibułę, nazywa się
Brak odpowiedzi na to pytanie.
Na etykietach substancji chemicznych można znaleźć oznaczenia literowe R i S (zgodnie z regulacjami CLP: H i P), które wskazują
Brak odpowiedzi na to pytanie.
Podczas przygotowywania roztworów buforowych do analizy pH w laboratorium istotne jest, aby:
Brak odpowiedzi na to pytanie.
Którego związku chemicznego, z uwagi na jego silne właściwości higroskopijne, nie powinno się używać w analizie miareczkowej jako substancji podstawowej?
Brak odpowiedzi na to pytanie.
Roztwór amoniaku o stężeniu 25% nie powinien być trzymany
Brak odpowiedzi na to pytanie.
Który z podanych związków chemicznych można wykorzystać do oceny całkowitego usunięcia jonów chlorkowych z osadu?
Brak odpowiedzi na to pytanie.
Jak definiuje się próbkę wzorcową?
Brak odpowiedzi na to pytanie.
Jakie urządzenie wykorzystuje się do określania lepkości płynów?
Brak odpowiedzi na to pytanie.
Który symbol literowy umieszczany na naczyniach miarowych wskazuje na kalibrację do "wlewu"?
Brak odpowiedzi na to pytanie.
Ile węglanu sodu trzeba odmierzyć, aby uzyskać 200 cm3 roztworu o stężeniu 8% (m/v)?
Brak odpowiedzi na to pytanie.
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
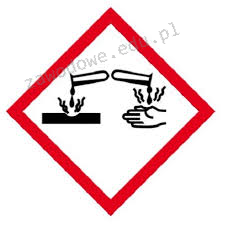
Brak odpowiedzi na to pytanie.
Substancje kancerogenne to
Brak odpowiedzi na to pytanie.
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
Brak odpowiedzi na to pytanie.
Na ilustracji oznaczono numery 1 i 4:
Brak odpowiedzi na to pytanie.
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
Brak odpowiedzi na to pytanie.
Jakie jest stężenie procentowe roztworu uzyskanego poprzez rozpuszczenie 25 g jodku potasu w 100 cm3 destylowanej wody (o gęstości 1 g/cm3)?
Brak odpowiedzi na to pytanie.
Oblicz, ile moli gazu można zebrać w pipecie gazowej o pojemności 500 cm3, jeśli gaz będzie gromadzony w warunkach normalnych. (W normalnych warunkach jeden mol gazu ma objętość 22,4 dm3)
Brak odpowiedzi na to pytanie.
Przedstawiony schemat ideowy ilustruje proces wytwarzania N2 → NO → NO2 → HNO3
Brak odpowiedzi na to pytanie.
Wapno palone uzyskuje się poprzez prażenie wapienia według równania: CaCO3 → CaO + CO2. Ile kilogramów wapienia należy zastosować, aby w efekcie jego prażenia otrzymać 7 kg wapna palonego, jeśli wydajność reakcji wynosi 50%?
Masy molowe: MCa = 40 g/mol, MC = 12 g/mol, MO = 16 g/mol.
Brak odpowiedzi na to pytanie.
Reakcja miedzi metalicznej z stężonym kwasem azotowym(V) prowadzi do powstania azotanu(V) miedzi(II) oraz jakiego związku?
Brak odpowiedzi na to pytanie.
W przypadku odczynnika, w którym nawet najczulsze techniki analizy chemicznej nie są w stanie wykryć zanieczyszczeń, a jego badanie wymaga zastosowania metod opartych na zjawiskach fizycznych, zalicza się on do kategorii czystości
Brak odpowiedzi na to pytanie.
Transportuje się pobrane próbki wody do analiz fizykochemicznych
Brak odpowiedzi na to pytanie.
Jeżeli partia towaru składa się z 10 dużych opakowań, wtedy z jednego opakowania pobiera się kilka próbek, które następnie łączy, uzyskując próbkę
Brak odpowiedzi na to pytanie.