Pytanie 1
Jeżeli partia towaru składa się z 10 dużych opakowań, wtedy z jednego opakowania pobiera się kilka próbek, które następnie łączy, uzyskując próbkę
Wynik: 18/40 punktów (45,0%)
Wymagane minimum: 20 punktów (50%)
Jeżeli partia towaru składa się z 10 dużych opakowań, wtedy z jednego opakowania pobiera się kilka próbek, które następnie łączy, uzyskując próbkę
Instrukcja dotycząca przygotowania wzorcowego roztworu NaCl
0,8242 g NaCl, które wcześniej wysuszono w temperaturze 140 °C do stałej masy, należy rozpuścić w kolbie miarowej o pojemności 1 dm3 w wodzie podwójnie destylowanej, a następnie uzupełnić do kreski tym samym rodzajem wody.
Z treści instrukcji wynika, że odpowiednio skompletowany sprzęt wymagany do sporządzenia wzorcowego roztworu NaCl, oprócz naczynia wagowego, powinien zawierać
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Naczynia miarowe, skalibrowane "na wlew" (IN) to:
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Stosunek masowy miedzi do siarki w siarczku miedzi(I) wynosi
| 16S Siarka 32 | 29Cu Miedź 63,55 |
Wagi laboratoryjne można klasyfikować według nośności oraz precyzji na
Jakim kolorem oznacza się instalację gazową w laboratorium analitycznym?
Na opakowaniu fenolu umieszcza się przedstawiony na rysunku znak ostrzegawczy, który oznacza, że jest to substancja

Czysty odczynnik (skrót: cz.) charakteryzuje się poziomem czystości wynoszącym
Co oznacza zapis cz.d.a. na etykiecie opakowania odczynnika chemicznego?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
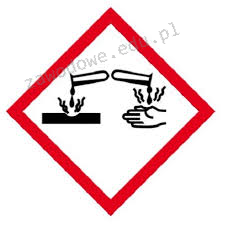
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Który z wskaźników nie jest używany w alkacymetrii?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Związki chromu(VI) oddziałują negatywnie na środowisko, ponieważ
Na podstawie zmierzonej temperatury topnienia można określić związek organiczny oraz ustalić jego
W przypadku zanieczyszczeń szklanych naczyń osadami o charakterze nieorganicznym, takimi jak wodorotlenki, tlenki oraz węglany, do ich oczyszczania używa się
Podstawowy zestaw do filtracji składa się ze statywu oraz
Do grupy reagentów o szczególnym zastosowaniu nie wlicza się
Podczas krystalizacji 210 g technicznego bezwodnego siarczanu(VI) cynku uzyskano 250 g ZnSO4 x 7H2O. Jaka była wydajność procesu krystalizacji?
Podczas przygotowywania roztworu mianowanego kwasu solnego o określonym stężeniu należy:
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Zamieszczony piktogram przedstawia substancję o klasie i kategorii zagrożenia:

Gdzie należy przechowywać cyjanek potasu KCN?
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
Jak nazywa się proces, w którym następuje wytrącenie ciała stałego z przesyconego roztworu w wyniku spadku temperatury?
Aby otrzymać roztwór AgNO3 (masa molowa AgNO3 to 169,8 g/mol) o stężeniu 0,1 mol/dm3, należy
W którym z podanych równań reakcji dochodzi do zmiany stopni utlenienia atomów?
Wodę do badań mikrobiologicznych powinno się pobierać do butelek
Aby przygotować miano kwasu solnego, konieczne jest odważenie węglanu sodu o masie wynoszącej około 400 mg. Jaką precyzję powinna mieć waga używana do odważenia węglanu sodu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który zestaw zawiera niezbędne urządzenia laboratoryjne do przygotowania 10% (m/m) roztworu NaCl?
Jakie substancje wykorzystuje się do wykrywania obecności jonów chlorkowych w wodzie mineralnej?
Nie należy podgrzewać cieczy w szczelnie zamkniętych pojemnikach, ponieważ
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.