Pytanie 1
Proces chemiczny, który polega na przejściu substancji w stanie stałym do roztworu, związany z reakcją tej substancji z rozpuszczalnikiem, to
Wynik: 27/40 punktów (67,5%)
Wymagane minimum: 20 punktów (50%)
Proces chemiczny, który polega na przejściu substancji w stanie stałym do roztworu, związany z reakcją tej substancji z rozpuszczalnikiem, to
Proces oddzielania składników jednorodnej mieszaniny, polegający na eliminacji jednego lub większej ilości składników z roztworu lub substancji stałej przy użyciu odpowiednio wybranego rozpuszczalnika, to
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Ile gramów chlorku baru powinno się rozpuścić w wodzie, aby uzyskać 200 cm3 roztworu o stężeniu 10% i gęstości 1,203 g/cm3?
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Jakie roztwory chemiczne powinny być stanowczo pobierane przy włączonym dygestorium?
Różnica pomiędzy średnim wynikiem pomiaru a wartością rzeczywistą stanowi błąd
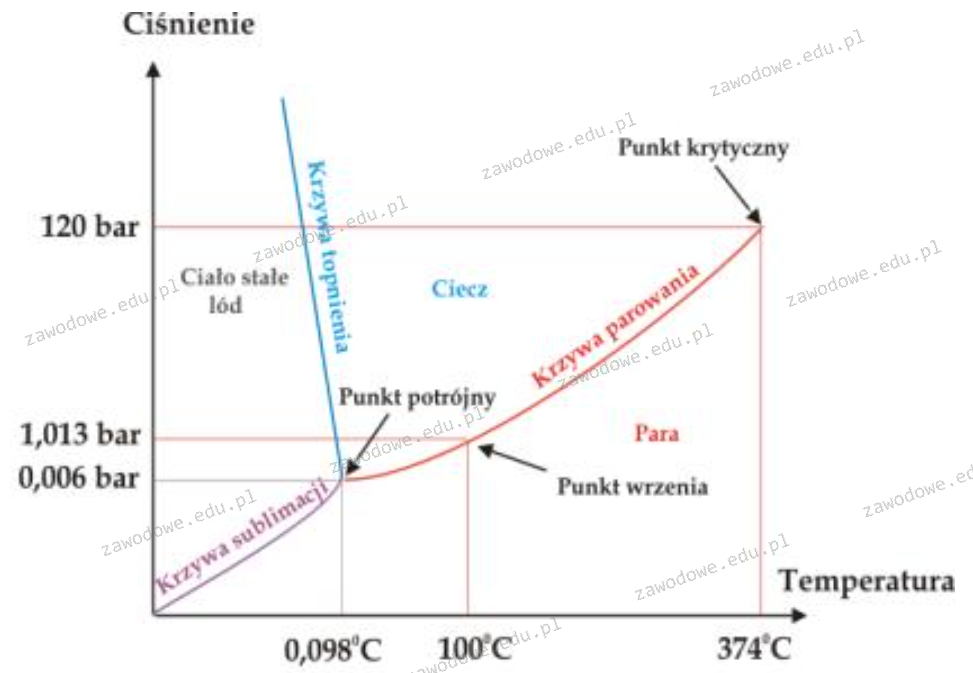
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Jakie oznaczenie znajduje się na naczyniach szklanych kalibrowanych do wlewu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Z 250 g benzenu (M = 78 g/mol) uzyskano 350 g nitrobenzenu (M = 123 g/mol). Jaka jest wydajność reakcji nitrowania?
Poniżej jest równanie reakcji prażenia węglanu wapnia. 200 g węglanu wapnia zawierającego 10% zanieczyszczeń poddano prażeniu. Masa otrzymanego tlenku wapnia wyniosła
| CaCO3 → CaO + CO2 |
| (MCaCO3 = 100 g/mol, MCaO = 56 g/mol, MCO2 = 44 g/mol) |
Metoda oczyszczania substancji, która opiera się na różnicy w rozpuszczalności substancji docelowej oraz zanieczyszczeń w zastosowanym rozpuszczalniku, nosi nazwę
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaką objętość roztworu NaOH o stężeniu 1 mol/dm3 należy użyć, aby przygotować 50 cm3 roztworu NaOH o stężeniu 0,4 mol/dm3?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jakie urządzenie służy do pomiaru temperatury topnienia substancji chemicznych?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który z podanych związków chemicznych można wykorzystać do oceny całkowitego usunięcia jonów chlorkowych z osadu?
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
Ogólna próbka, jednostkowa lub pierwotna powinna
Przy transporcie próbek wody zaleca się, aby próbki były
Ile masy kwasu mrówkowego jest wymagane do uzyskania 11,2 dm3 tlenku węgla(II) (w warunkach normalnych) w procesie odwodnienia kwasu mrówkowego (M = 46 g/mol) za pomocą kwasu siarkowego(VI), zakładając efektywność procesu na poziomie 70%?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Co oznacza skrót AKT?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Jaka minimalna pojemność powinna mieć miarka, aby jednorazowo zmierzyć 60,0 cm3 wody?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Podczas łączenia bezwodnego etanolu z wodą występuje zjawisko kontrakcji. Gdy zmieszamy 1000 cm3 wody oraz 1000 cm3 etanolu, otrzymujemy roztwór o objętości
Próbka wzorcowa to próbka
Podaj kolejność odczynników chemicznych według rosnącego stopnia czystości?
Jak definiuje się próbkę wzorcową?
Aby odróżnić urządzenia w laboratorium chemicznym, rury do próżni maluje się w kolorze
Jaką masę NaCl uzyskuje się poprzez odparowanie do sucha 250 g roztworu 10%?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który z poniższych sposobów homogenizacji próbki jest najbardziej odpowiedni do przygotowania próbki gleby do analizy chemicznej?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry