Pytanie 1
W procesie oddzielania osadu od roztworu, po przeniesieniu osadu na sączek, najpierw należy go
Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
W procesie oddzielania osadu od roztworu, po przeniesieniu osadu na sączek, najpierw należy go
200 g soli zostało poddane procesowi oczyszczania poprzez krystalizację. Uzyskano 125 g czystego produktu. Jaką wydajność miała krystalizacja?
Rozpuszczalnik stosowany w procesie krystalizacji powinien
Aby rozpuścić próbkę tłuszczu o wadze 5 g, wykorzystuje się 50 cm3 mieszanki 96% alkoholu etylowego oraz eteru dietylowego, połączonych w proporcji objętościowej 1 : 2. Jakie ilości cm3 każdego ze składników są potrzebne do przygotowania 150 cm3 tej mieszanki?
Jakie pH ma roztwór buforowy otrzymany w wyniku zmieszania 0,2 M roztworu kwasu octowego i 0,2 M roztworu octanu sodu, w stosunku objętościowym 3 : 2?
| Bufor octanowy według Walpole'a | ||
|---|---|---|
| 0,2 M kwas octowy [ml] | 0,2 M octan sodu [ml] | pH |
| 7,0 | 3,0 | 4,39 |
| 6,0 | 4,0 | 4,58 |
| 5,0 | 5,0 | 4,75 |
| 4,0 | 6,0 | 4,94 |
| 3,0 | 7,0 | 5,13 |
Wskaż, do jakiego typu należą zamieszczone równania reakcji.
| I. 2 Mg + O2 → 2 MgO |
| II. 2 KMnO4 → K2MnO4 + MnO2 + O2 |
| III. BaCl2 + H2SO4→ BaSO4 + 2 HCl |
Wybierz spośród wymienionych właściwości tę, która nie dotyczy naczyń kwarcowych.
Co oznacza zapis cz.d.a. na etykiecie opakowania odczynnika chemicznego?
Jakie jest stężenie roztworu NaOH, który zawiera 4 g wodorotlenku sodu w 1 dm3 (masa molowa NaOH = 40 g/mol)?
Z próbki zawierającej siarczany(VI) należy najpierw wydzielić metodą filtracji zanieczyszczenia, które są nierozpuszczalne w wodzie. Dokładność wypłukania tych zanieczyszczeń weryfikuje się za pomocą roztworu
Odlanie cieczy z nad osadu to
Zawarty fragment instrukcji odnosi się do
Po dodaniu do kolby Kjeldahla próbki analizowanego materiału, kwasu siarkowego(VI) oraz katalizatora, należy delikatnie ogrzewać zawartość kolby za pomocą palnika gazowego. W początkowym etapie ogrzewania zawartość kolby wykazuje pienienie i zmienia kolor na ciemniejszy. W tym czasie należy przeprowadzać ogrzewanie bardzo ostrożnie, a nawet z przerwami, aby uniknąć "wydostania się" czarnobrunatnej masy do szyjki kolby.
Proces mineralizacji próbki, który polega na jej spopieleniu w piecu muflowym w temperaturze 300-500°C i rozpuszczeniu pozostałych resztek w kwasach w celu oznaczenia zawartości metali ciężkich, to mineralizacja
Urządzeniem pomiarowym nie jest
Odważka analityczna wodorotlenku sodu, przygotowana fabrycznie, zawiera 0,1 mola NaOH. Jaką objętość wody destylowanej należy dodać w kolbie miarowej, aby uzyskać roztwór wodorotlenku sodu o stężeniu 0,0500 mol/dm3?
Który z poniższych zestawów obejmuje jedynie sprzęt do pomiarów?
Naczynia miarowe kalibrowane "na wlew" mają oznaczenie w postaci symbolu
Odczynnik, który w specyficznych warunkach reaguje wyłącznie z danym jonem, umożliwiając tym samym jego identyfikację w mieszance, to odczynnik
W jakiej standardowej temperaturze są kalibrowane szklane naczynia pomiarowe?
Aby przygotować roztwór wzorcowy potrzebny do oznaczania miana, konieczne jest użycie odczynnika chemicznego o czystości przynajmniej
Losowo należy pobierać próbki z opakowań
W przypadku zanieczyszczeń szklanych naczyń osadami o charakterze nieorganicznym, takimi jak wodorotlenki, tlenki oraz węglany, do ich oczyszczania używa się
Błąd związany z odczytem poziomu cieczy w kolbie miarowej, spowodowany niewłaściwą pozycją oka w stosunku do skali, nazywany jest błędem
Jakie urządzenie wykorzystuje się do pobierania próbek gazów?
Komora przeszklona w formie dużej szafy, wyposażona w wentylator, która zapobiega wydostawaniu się szkodliwych substancji do atmosfery laboratorium oraz chroni przed pożarami i eksplozjami, to
Proces oddzielania cieczy od osadu nazywa się
Aby uzyskać całkowicie bezwodny Na2CO3, przeprowadzono prażenie 143 g Na2CO3·10H2O (M = 286 g/mol). Po upływie zalecanego czasu prażenia odnotowano utratę masy 90 g. W związku z tym prażenie należy
W parownicy porcelanowej, w której znajduje się 2,5 g naftalenu, umieść krążek bibuły z niewielkimi otworami oraz odwrócony lejek szklany. Zatyczkę lejka zrób z korka z waty. Parownicę umieść w płaszczu grzejnym. Po delikatnym ogrzaniu parownicy, pary substancji przechodzą przez otwory w bibule i kondensują na wewnętrznych ściankach lejka... Powyższy opis dotyczy metody oczyszczania naftalenu przez
W celu wydania świadectwa kontroli jakości odczynnika chemicznego - jodku potasu cz.d.a. przeprowadzono jego analizę. Wymagania oraz wyniki badań zapisano w tabeli:
Z analizy danych zawartych w tabeli wynika, że jodek potasu cz.d.a.
| Wymagania | Wynik badania | |
|---|---|---|
| Zawartość KI | min. 99,5% | 99,65% |
| Wilgoć | max. 0,1% | 0,075% |
| Substancje nierozpuszczalne w wodzie | max. 0,005% | 0,002% |
| pH (5%, H2O) | 6 ÷ 8 | 6,8 |
| Azot ogólny (N) | max. 0,001% | 0,0007% |
| Chlorki i bromki (j. Cl) | max. 0,01% | 0,004% |
| Fosforany (PO4) | max. 0,001% | 0,0006% |
| Jodany (IO3) | max. 0,0003% | 0,0001% |
| Siarczany (SO4) | max. 0,001% | 0,0004% |
| Metale ciężkie (j. Pb) | max. 0,0005% | 0,00025% |
| Arsen (As) | max. 0,00001% | 0,000006% |
| Magnez (Mg) | max. 0,001% | 0,0004% |
| Sód (Na) | max. 0,05% | 0,015% |
| Wapń (Ca) | max. 0,001% | 0,0006% |
| Żelazo (Fe) | max. 0,0003% | 0,0003% |
Zabieg, który wykonuje się podczas pobierania próbki wody do analizy, mający na celu zachowanie jej składu chemicznego w trakcie transportu, określa się mianem
W celu uzyskania 500 g mieszaniny oziębiającej o temperaturze -18oC należy zmieszać
| Tabela. Mieszaniny oziębiające | ||
|---|---|---|
| Temperatura mieszaniny [°C] | Skład mieszaniny | Stosunek masowy |
| -2 | Woda + chlorek amonu | 10 : 3 |
| -15 | Woda + rodanek amonu | 10 : 13 |
| -18 | Lód + chlorek amonu | 10 : 3 |
| -21 | Lód + chlorek sodu | 3 : 1 |
| -22 | Lód + chlorek amonu + azotan(V) amonu | 25 : 5 : 11 |
| -25 | Lód + azotan(V) amonu | 1 : 1 |
Próbkę wody przeznaczoną do oznaczenia zawartości metali poddaje się utrwalaniu za pomocą
| Sposoby utrwalania i przechowywania próbek wody przeznaczonych do badań fizykochemicznych. | |
|---|---|
| Oznaczenie | Sposób utrwalania i przechowywania |
| Barwa | Przechowywać w ciemności |
| Mętność | Przechowywać w ciemności |
| Twardość | pH = 3 z użyciem HNO₃ |
| OWO | 0,7 ml HCl/30 ml próbki |
| ChZT | pH 1-2 z użyciem H₂SO₄ |
| Fosfor | Przechowywać w temperaturze 1-5°C |
| Glin | pH 1-2 z użyciem HNO₃ |
| Żelazo | pH 1-2 z użyciem HNO₃ |
| Utlenialność | pH1-2 z użyciem H₂SO₄. Przechowywać w ciemności |
Substancje, które wykorzystuje się do ustalania miana roztworu, to
Próbka laboratoryjna posiadająca cechy higroskopijne powinna być pakowana
Przedstawiono wyciąg z karty charakterystyki substancji chemicznej. Na podstawie informacji zawartej w zamieszczonym fragmencie karty wskaż wzór chemiczny substancji, której można użyć jako materiału neutralizującego lodowaty kwas octowy.
Kwas octowy lodowaty 99,5% Materiały zapobiegające rozprzestrzenianiu się skażenia i służące do usuwania skażenia Jeżeli to możliwe i bezpieczne, zlikwidować lub ograniczyć wyciek (uszczelnić, zamknąć dopływ cieczy, uszkodzone opakowanie umieścić w opakowaniu awaryjnym). Ograniczyć rozprzestrzenianie się rozlewiska przez obwałowanie terenu; zebrane duże ilości cieczy odpompować. Małe ilości rozlanej cieczy przysypać niepalnym materiałem chłonnym (ziemia, piasek oraz materiałami neutralizującymi kwasy, np. węglanem wapnia lub sodu, zmielonym wapieniem, dolomitem), zebrać do zamykanego pojemnika i przekazać do zniszczenia. Zanieczyszczoną powierzchnię spłukać wodą. Popłuczyny zebrać i usunąć jako odpad niebezpieczny. |
Po przeprowadzeniu krystalizacji z 120 g kwasu szczawiowego uzyskano 105 g produktu o wysokiej czystości. Jaki był poziom zanieczyszczeń w kwasie szczawiowym?
W trakcie destylacji cieczy wykorzystuje się tzw. kamienie wrzenne, ponieważ
Na rysunku przedstawiono wagę

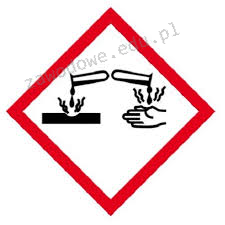
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
W tabeli przestawiono dane dotyczące wybranych roztworów wodnych wodorotlenku sodu.
Oblicz masę wodorotlenku sodu, jaką należy rozpuścić w 200,0 cm3 wody, aby otrzymać roztwór o gęstości 1,0428 g/cm3.
| d420 [g/cm3] | masa NaOH [g/100 cm3] |
|---|---|
| 1,0095 | 1,01 |
| 1,0207 | 2,04 |
| 1,0428 | 4,17 |
| 1,0648 | 6,39 |
| 1,0869 | 8,70 |
| 1,1089 | 11,09 |