Pytanie 1
Wskaż zbiór substancji, które po rozpuszczeniu w wodzie stają się elektrolitami?
Wynik: 19/40 punktów (47,5%)
Wymagane minimum: 20 punktów (50%)
Wskaż zbiór substancji, które po rozpuszczeniu w wodzie stają się elektrolitami?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Na podstawie informacji zawartej na pipecie, została ona skalibrowana na
Które z poniższych działań należy wykonać przed rozpoczęciem pracy z nowym szkłem laboratoryjnym?
Temperatura wrzenia aniliny przy normalnym ciśnieniu wynosi 457,13 K. W trakcie jej oczyszczania metodą destylacji prostej pod ciśnieniem atmosferycznym należy zebrać frakcję wrzącą w przedziale temperatur
Odlanie cieczy z nad osadu to
Do narzędzi pomiarowych zalicza się
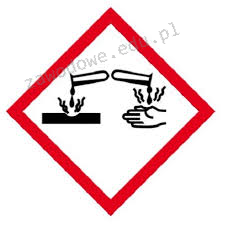
Na etykiecie kwasu siarkowego(VI) znajduje się piktogram pokazany na rysunku. Oznacza to, że substancja ta jest
Wykonano ocenę jakości dostarczonej partii wodorotlenku sodu.
Zgodne ze specyfikacją towaru są
| Parametr oznaczany | Jednostka | Wartość parametru | |
|---|---|---|---|
| Według specyfikacji | Zbadana analitycznie | ||
| Zawartość wodorotlenku sodu | % | >=98 | 98,3 |
| Zawartość węglanu sodu | % | <=0,4 | 0,39 |
| Zawartość chlorku sodu | % | <=0,015 | 0,015 |
Jaką próbkę stanowi woreczek gleby pobranej zgodnie z instrukcją?
| Instrukcja pobierania próbek glebowych | |
| Próbki pierwotne pobiera się laską glebową z wierzchniej warstwy gleby 0-20 cm, kolejno wykonując czynności: – w miejscu pobierania próbki pierwotnej (pojedynczej), rolę świeżo zaoraną przydeptać, – pionowo ustawić laskę do powierzchni gleby, – wcisnąć laskę do oporu (na wysokość poprzeczki ograniczającej), – wykonać pełny obrót i wyjąć laskę, – zawartość wgłębienia (zasobnika) przenieść do pojemnika skrobaczki. Po pobraniu próbek pojedynczych, całość wymieszać i napełnić kartonik lub woreczek. | |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Po zmieszaniu wszystkie pierwotne próbki danej partii materiału tworzą próbkę
Aby uzyskać całkowicie bezwodny Na2CO3, przeprowadzono prażenie 143 g Na2CO3·10H2O (M = 286 g/mol). Po upływie zalecanego czasu prażenia odnotowano utratę masy 90 g. W związku z tym prażenie należy
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Kalibracja pH-metru nie jest potrzebna po
Odważka analityczna wodorotlenku sodu, przygotowana fabrycznie, zawiera 0,1 mola NaOH. Jaką objętość wody destylowanej należy dodać w kolbie miarowej, aby uzyskać roztwór wodorotlenku sodu o stężeniu 0,0500 mol/dm3?
Średnia masa wody wypływająca z pipety o deklarowanej pojemności 25 cm3, w temperaturze 25°C wynosi 24,80 g. Korzystając z danych zamieszczonych w tabeli wskaż wartość poprawki kalibracyjnej dla tej pipety.
| Masa wody zajmującej objętość 1 dm3 w zależności od temperatury pomiaru | |
|---|---|
| Temperatura °C | Masa wody g |
| 20 | 997,17 |
| 21 | 997,00 |
| 22 | 996,80 |
| 23 | 996,59 |
| 24 | 996,38 |
| 25 | 996,16 |
| 26 | 995,93 |
| 27 | 995,69 |
| 28 | 995,45 |
| 29 | 995,18 |
| 30 | 994,92 |
Butle gazowe (czasy butli) napełnione wodorem są oznaczone kolorem
Po przeprowadzeniu krystalizacji z 120 g kwasu szczawiowego uzyskano 105 g produktu o wysokiej czystości. Jaki był poziom zanieczyszczeń w kwasie szczawiowym?
Ile gramów 80% kwasu mrówkowego trzeba zważyć, aby uzyskać 200 g 20% roztworu tego kwasu?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Odczynnik, który nie został wykorzystany, należy zutylizować zgodnie z informacjami zawartymi na etykiecie
Jakie jest stężenie roztworu NaOH, który zawiera 4 g wodorotlenku sodu w 1 dm3 (masa molowa NaOH = 40 g/mol)?
Co oznacza zapis cz.d.a. na etykiecie opakowania odczynnika chemicznego?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Przedstawiony sposób dotyczy pobierania próbki wody do przeprowadzenia badań
| Sposób pobierania próbki wody do przeprowadzenia badań: - próbki pobrać do sterylnych butelek; - przed przystąpieniem do pobierania wody zdjąć z kurka wszelkie urządzenia, zeskrobać zanieczyszczenia, następnie całkowicie otwierając i zamykając zawór, wielokrotnie płukać; - metalowy kurek wysterylizować płomieniem, a kurek z tworzywa sztucznego alkoholem etylowym; - kurek otworzyć do połowy przepływu i spuszczać wodę przez około 2-3 minuty do osiągnięcia stałej temperatury; - pobrać próbkę wody napełniając butelkę do około ¾ objętości i natychmiast zamknąć korkiem. |
Na podstawie danych w tabeli próbkę, w której będzie oznaczany BZT, należy przechowywać
| Oznaczany parametr | Rodzaj naczynia do przechowywania | Sposób utrwalania | Dopuszczalny czas przechowywania |
|---|---|---|---|
| barwa | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C | 24 h |
| fosforany ogólne | szklane lub polietylenowe | - zakwaszenie kwasem siarkowym(VI) - schłodzenie do temperatury 2-5°C | 4 h 48 h |
| BZT | szklane | - schłodzenie do temperatury 2-5°C - przechowywanie w ciemności | 24 h |
| azot azotanowy(V) | szklane lub polietylenowe | - schłodzenie do temperatury 2-5°C - dodanie 2 cm3 chloroformu do 1 dm3 próbki | 24 h 48 h |
Roztwory o ściśle określonym stężeniu, używane w analizach miareczkowych, nazywamy
Którego związku chemicznego, z uwagi na jego silne właściwości higroskopijne, nie powinno się używać w analizie miareczkowej jako substancji podstawowej?
Metodą, która nie umożliwia przeniesienia składników próbki do roztworu, jest
W tabeli zamieszczono temperatury wrzenia niektórych składników powietrza. Na podstawie tych danych podaj, który ze składników oddestyluje jako ostatni.
| Temperatura wrzenia °C | Składniki |
|---|---|
| -245,9 | Neon |
| -182,96 | Tlen |
| -195,8 | Azot |
| -185,7 | Argon |
Aby ustalić miano roztworu wodnego NaOH, należy zastosować
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
W procesie oddzielania osadu od roztworu, po przeniesieniu osadu na sączek, najpierw należy go
Wagi laboratoryjne można klasyfikować według nośności oraz precyzji na
Laboratoryjny aparat szklany, który wykorzystuje kwasy do wytwarzania gazów w reakcji z metalem lub odpowiednią solą, to
Materiał uzyskany przez zmieszanie prób pobranych w ustalonych odstępach czasu określa się mianem próbki
Na podstawie informacji zawartych w tabeli wskaż mieszaninę oziębiającą o temperaturze -21 °C.
| Temperatura mieszaniny | Skład mieszaniny | Stosunek masowy |
| -15 °C | lód + octan sodu | 10:9 |
| -18 °C | lód + chlorek amonu | 10:3 |
| -21 °C | lód + chlorek sodu | 3:1 |
| -25 °C | lód + azotan amonu | 1:9 |
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.