Pytanie 1
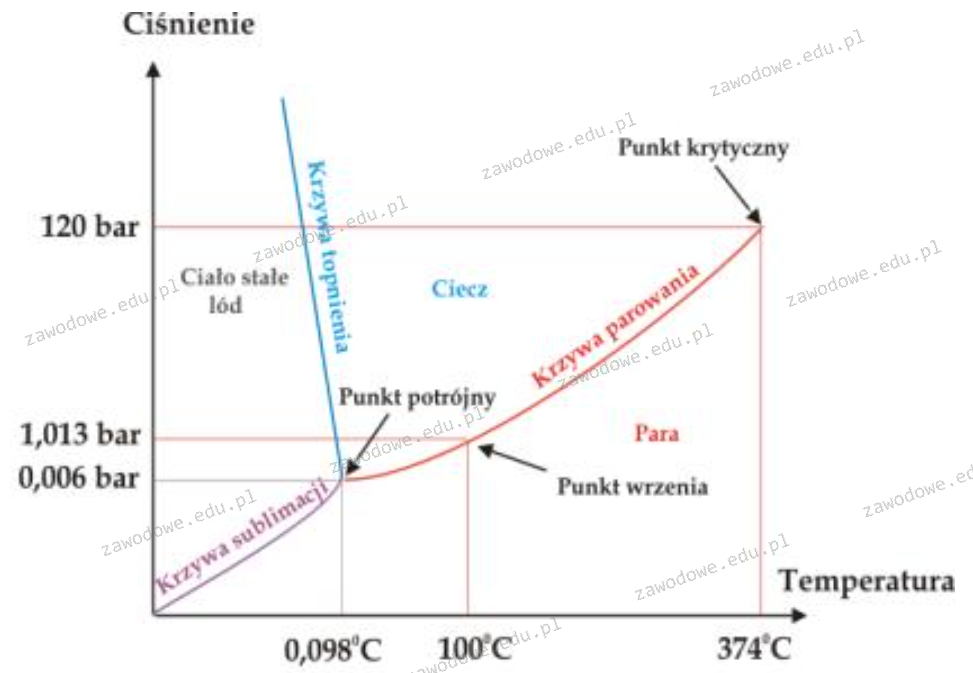
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.
Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
Korzystając z wykresu wskaż, w jakiej postaci występuje woda w temperaturze 10°C i pod ciśnieniem 100 barów.

Zaleca się schładzanie próbek wody transportowanych do laboratorium do temperatury
Instrukcja dotycząca przygotowania wzorcowego roztworu NaCl
0,8242 g NaCl, które wcześniej wysuszono w temperaturze 140 °C do stałej masy, należy rozpuścić w kolbie miarowej o pojemności 1 dm3 w wodzie podwójnie destylowanej, a następnie uzupełnić do kreski tym samym rodzajem wody.
Z treści instrukcji wynika, że odpowiednio skompletowany sprzęt wymagany do sporządzenia wzorcowego roztworu NaCl, oprócz naczynia wagowego, powinien zawierać
Podstawowy zestaw do filtracji składa się ze statywu oraz
Do wykrywania pierwiastków w niskich stężeniach w badaniach spektrograficznych należy używać reagentów
Do grupy reagentów o szczególnym zastosowaniu nie wlicza się
Zgodnie z danymi zawartymi w tabeli wskaźników roztwór obojętny będzie miał barwę
| Wskaźnik | Zakres zmiany barwy (w jednostkach pH) | Barwa w środowisku | |
|---|---|---|---|
| kwaśnym | zasadowym | ||
| błękit tymolowy | 1,2 – 2,8 | czerwona | żółta |
| oranż metylowy | 3,1 – 4,4 | czerwona | żółta |
| czerwień metylowa | 4,8 – 6,0 | czerwona | żółta |
| czerwień chlorofenolowa | 5,2 – 6,8 | żółta | czerwona |
| błękit bromotymolowy | 6,0 – 7,6 | żółta | niebieska |
| czerwień fenolowa | 6,6 – 8,0 | żółta | czerwona |
| błękit tymolowy | 8,0 – 9,6 | żółta | niebieska |
| fenoloftaleina | 8,2 – 10,0 | bezbarwna | czerwona |
| żółcień alizarynowa | 10,1 – 12,0 | żółta | zielona |
W tabeli przestawiono dane dotyczące wybranych roztworów wodnych wodorotlenku sodu.
Oblicz masę wodorotlenku sodu, jaką należy rozpuścić w 200,0 cm3 wody, aby otrzymać roztwór o gęstości 1,0428 g/cm3.
| d420 [g/cm3] | masa NaOH [g/100 cm3] |
|---|---|
| 1,0095 | 1,01 |
| 1,0207 | 2,04 |
| 1,0428 | 4,17 |
| 1,0648 | 6,39 |
| 1,0869 | 8,70 |
| 1,1089 | 11,09 |
Mianowanie roztworu KMnO4 następuje według poniższej procedury:
Około 0,2 g szczawianu sodu, ważonego z dokładnością ±0,1 mg, przenosi się do kolby stożkowej, rozpuszcza w około 100 cm3 wody destylowanej, następnie dodaje się 10 cm3 roztworu kwasu siarkowego(VI) i podgrzewa do temperatury około 70 °C. Miareczkowanie przeprowadza się roztworem KMnO4 do momentu uzyskania trwałego, jasnoróżowego koloru.
Powyższa procedura odnosi się do miareczkowania
Podczas pipetowania menisk górny określa się dla roztworów
Aby uzyskać roztwór 25 gramów CuSO4 w 50 gramach wody, konieczne jest podgrzanie mieszanki do temperatury w przybliżeniu
Wybierz poprawny zapis jonowy spośród podanych reakcji, w których otrzymywany jest siarczan(VI) baru.
Procedura oznaczenia kwasowości mleka. Do wykonania analizy, zgodnie z powyższą procedurą, potrzebne są
| Do kolby stożkowej o pojemności 300 cm3 pobrać dokładnie 25 cm3 badanego mleka i rozcieńczyć wodą destylowaną do objętości 50 cm3. Dodać 2-3 krople fenoloftaleiny i miareczkować mianowanym roztworem wodorotlenku sodu do uzyskania lekko różowego zabarwienia. |
Jakie środki ochronne należy zastosować podczas sporządzania 1M roztworu zasady sodowej ze stężonego roztworu NaOH, na opakowaniu którego widnieje oznaczenie S/36/37/39?
| Numer zwrotu S | Warunki bezpiecznego stosowania |
|---|---|
| S36 | Używać odpowiedniej odzieży ochronnej |
| S37 | Używać odpowiednich rękawic |
| S38 | W przypadku niewystarczającej wentylacji używać sprzętu do oddychania |
| S39 | Używać okularów lub maski ochronnej |
Do szklanych narzędzi laboratoryjnych wielomiarowych używanych w analizach ilościowych należy
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Aby przygotować 250 cm3 roztworu wodorotlenku potasu o stężeniu 0,25 mola, potrzebne będzie
W wyniku rozkładu 100 g węglanu wapnia, otrzymano 25 g tlenku wapnia. Wydajność procentowa reakcji wynosi
| MCaCO3 = 100g / mol | MCaO = 56g / mol |
Stosunek masowy miedzi do siarki w siarczku miedzi(I) wynosi
| 16S Siarka 32 | 29Cu Miedź 63,55 |
Które z wymienionych reakcji chemicznych stanowi reakcję redoks?
Wodę do badań mikrobiologicznych powinno się pobierać do butelek
W wypadku oblania skóry kwasem mrówkowym należy
| Wyciąg z karty charakterystyki Skład: kwas mrówkowy 80%, woda 11-20% Pierwsza pomoc. Po narażeniu przez drogi oddechowe. Natychmiast wezwać lekarza. Po kontakcie ze skórą. Zanieczyszczoną skórę natychmiast przemyć dużą ilością wody. |
Związki chromu(VI) oddziałują negatywnie na środowisko, ponieważ
Metodą, która nie służy do utrwalania próbek wody, jest
Ile gramów chlorku baru powinno się rozpuścić w wodzie, aby uzyskać 200 cm3 roztworu o stężeniu 10% i gęstości 1,203 g/cm3?
Najskuteczniejszą techniką separacji ketonu oraz kwasu karboksylowego obecnych w roztworze benzenowym jest
Z próbek przygotowuje się ogólną próbkę
Aby oddzielić galaretowaty osad typu Fe(OH)3 od roztworu, jaki sączek należy zastosować?
Jakie urządzenie wykorzystuje się do pobierania próbek gazów?
Aby przygotować zestaw do filtracji, należy zebrać
Deminimalizowaną wodę można uzyskać przez
Jakie jest stężenie roztworu HNO3, który powstał w wyniku połączenia 50 cm3 roztworu HNO3 o stężeniu 0,2 mol/dm3 oraz 25 cm3 roztworu HNO3 o stężeniu 0,5 mol/dm3?
Do przechowywania zamrożonych próbek wody stosuje się naczynia wykonane
W celu przygotowania 100 cm3 roztworu mianowanego, jaką kolbę należy zastosować?
Użycie płuczek jest konieczne w trakcie procesu
Przy przygotowywaniu 100 cm3 roztworu o określonym stężeniu procentowym (m/V) konieczne jest odważenie wyliczonej ilości substancji, a następnie przeniesienie jej do
Ile wynosi objętość roztworu o stężeniu 0,5 mol/dm3, jeśli przygotowano go z 0,1 mola KOH?
Który z wskaźników nie jest używany w alkacymetrii?
Z uwagi na bezpieczeństwo pracy, ciecze żrące powinny być podgrzewane w łaźniach
Jakie jest znaczenie skrótu: cz. na etykiecie reagentu chemicznego?