Pytanie 1
Do przechowywania zamrożonych próbek wody stosuje się naczynia wykonane
Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
Do przechowywania zamrożonych próbek wody stosuje się naczynia wykonane
Odczynnik chemiczny, w którym zawartość domieszek wynosi od 1 do 10%, jest nazywany odczynnikiem
Który z wskaźników nie jest używany w alkacymetrii?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Które z poniższych równań ilustruje reakcję, w której powstają produkty gazowe?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Który z poniższych zestawów obejmuje jedynie sprzęt do pomiarów?
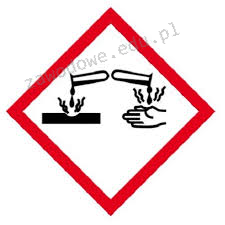
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Czy odpady laboratoryjne zawierające jony metali ciężkich powinny zostać poddane obróbce przed umieszczeniem ich w odpowiednio oznaczonej pojemności?
Ogólna próbka, jednostkowa lub pierwotna powinna
Podczas pipetowania menisk górny określa się dla roztworów
W próbkach obecne są składniki, które znacznie różnią się pod względem zawartości. Składnik, którego procentowy udział w próbce jest niższy od 0,01%, nazywamy
Który z poniższych sposobów homogenizacji próbki jest najbardziej odpowiedni do przygotowania próbki gleby do analizy chemicznej?
Aby oddzielić mieszankę etanolu i wody, konieczne jest przeprowadzenie procesu
Skuteczny środek do osuszania
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Roztwory o ściśle określonym stężeniu, używane w analizach miareczkowych, nazywamy
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Wszystkie pojemniki z odpadami, zarówno stałymi, jak i ciekłymi, które są przekazywane do służby zajmującej się utylizacją, powinny być opatrzone informacjami
Nie należy używać do czyszczenia szklanych naczyń laboratoryjnych
Dekantacja to metoda
Analiza technicznego kwasu solnego dała następujące wyniki: 30% HCl, 0,008% H2SO4, 0,04% Fe.
Korzystając z zamieszczonej tabeli wymagań, określ gatunek kwasu, pamiętając, że decyduje o nim najgorszy wskaźnik.
| Wymagania chemiczne dotyczące kwasu siarkowego | ||||
| Wymagania | Gatunki | |||
| I | II | III | IV | |
| Chlorowodór, % | > 33 | > 29 | > 28 | > 27 |
| Kwas siarkowy(VI) w przel. na SO42-, % | < 0,009 | < 0,5 | < 1,6 | < 1,8 |
| Żelazo (Fe3+), % | < 0,005 | < 0,03 | < 0,03 | < 0,05 |
Brak odpowiedzi na to pytanie.
Jaką masę NaCl uzyskuje się poprzez odparowanie do sucha 250 g roztworu 10%?
Metoda oczyszczania substancji oparta na różnicach w rozpuszczalności poszczególnych składników w określonym rozpuszczalniku to
Destylacja to metoda
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Do narzędzi pomiarowych zalicza się
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Piktogram ukazujący czaszkę oraz skrzyżowane kości piszczelowe jest typowy dla substancji o działaniu
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Połączono równe ilości cynku i bromu, a następnie poddano je reakcji Zn + Br2 → ZnBr2. W tych warunkach stopień reakcji cynku wynosi (masy atomowe: Zn – 65u, Br – 80u)?
Procedura oznaczenia kwasowości mleka. Do wykonania analizy, zgodnie z powyższą procedurą, potrzebne są
| Do kolby stożkowej o pojemności 300 cm3 pobrać dokładnie 25 cm3 badanego mleka i rozcieńczyć wodą destylowaną do objętości 50 cm3. Dodać 2-3 krople fenoloftaleiny i miareczkować mianowanym roztworem wodorotlenku sodu do uzyskania lekko różowego zabarwienia. |
Do filtracji osadów drobnokrystalicznych wykorzystuje się filtry
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.
Aby uzyskać roztwór 25 gramów CuSO4 w 50 gramach wody, konieczne jest podgrzanie mieszanki do temperatury w przybliżeniu
Brak odpowiedzi na to pytanie.
Wskaź zestaw reagentów oraz przyrządów wymaganych do przygotowania 0,5 dm3 roztworu HCl o stężeniu 0,2 mol/dm3?
Na podstawie danych zawartych w tabeli wskaż, który dodatek należy zastosować, w celu konserwacji próbek wody przeznaczonych do oznaczania jej twardości.
| Tabela. Techniki konserwacji próbek wody | |
|---|---|
| Stosowany dodatek lub technika | Rodzaje próbek, do których dodatek lub technika jest stosowana |
| Kwas siarkowy(VI) | zawierające węgiel organiczny, oleje lub tłuszcze, przeznaczone do oznaczania ChZT, zawierające aminy lub amoniak |
| Kwas azotowy(V) | zawierające związki metali |
| Wodorotlenek sodu | zawierające lotne kwasy organiczne lub cyjanki |
| Chlorek rtęci(II) | zawierające biodegradowalne związki organiczne oraz różne formy azotu i fosforu |
| Chłodzenie w temperaturze 4°C | zawierające mikroorganizmy, barwę, zapach, organiczne formy węgla, azotu i fosforu, przeznaczone do określenia kwasowości, zasadowości oraz BZT |
Aby uniknąć trwałego połączenia szlifowanych części sprzętu laboratoryjnego, co należy zrobić?
To pytanie jest dostępne tylko dla zalogowanych użytkowników. Zaloguj się lub utwórz konto aby zobaczyć pełną treść pytania.
Odpowiedzi dostępne po zalogowaniu.
Wyjaśnienie dostępne po zalogowaniu.