Pytanie 1
Na etykietach substancji chemicznych można znaleźć oznaczenia literowe R i S (zgodnie z regulacjami CLP: H i P), które wskazują
Wynik: 32/40 punktów (80,0%)
Wymagane minimum: 20 punktów (50%)
Na etykietach substancji chemicznych można znaleźć oznaczenia literowe R i S (zgodnie z regulacjami CLP: H i P), które wskazują
Aby odróżnić urządzenia w laboratorium chemicznym, rury do próżni maluje się w kolorze
Które równanie przedstawia reakcję otrzymywania mydła?
| CH3COOH + NaOH →CH3COONa + H2O |
| 2 CH3COOH + Na2O →2 CH3COONa + H2O |
| 2 C2H5COOH + 2 Na →2 C2H5COONa + H2↑ |
| C17H35COOH + NaOH →C17H35COONa + H2O |
Który symbol literowy umieszczany na naczyniach miarowych wskazuje na kalibrację do "wlewu"?
Który zestaw zawiera niezbędne urządzenia laboratoryjne do przygotowania 10% (m/m) roztworu NaCl?
Resztki szkła, osadników czy inne odpady stałe powstałe w laboratorium analitycznym powinny być umieszczone
Które z wymienionych reakcji chemicznych stanowi reakcję redoks?
Średnia masa wody wypływająca z pipety o deklarowanej pojemności 25 cm3, w temperaturze 25°C wynosi 24,80 g. Korzystając z danych zamieszczonych w tabeli wskaż wartość poprawki kalibracyjnej dla tej pipety.
| Masa wody zajmującej objętość 1 dm3 w zależności od temperatury pomiaru | |
|---|---|
| Temperatura °C | Masa wody g |
| 20 | 997,17 |
| 21 | 997,00 |
| 22 | 996,80 |
| 23 | 996,59 |
| 24 | 996,38 |
| 25 | 996,16 |
| 26 | 995,93 |
| 27 | 995,69 |
| 28 | 995,45 |
| 29 | 995,18 |
| 30 | 994,92 |
Odpady, które w przeważającej mierze składają się z osadów siarczków metali ciężkich, nazywa się
W karcie charakterystyki pewnej substancji znajduje się piktogram dotyczący transportu. Jest to substancja z grupy szkodliwych dla zdrowia

Dokonano pomiaru pH dwóch roztworów, uzyskując wartości pH= 2 oraz pH= 5. Wskaźnij poprawnie sformułowany wniosek.
Aby odcedzić galaretowaty osad, konieczne jest użycie sączka
Aby w badanej próbie w trakcie zmiany pH nastąpiła zmiana barwy na malinową, należy użyć
| Zmiany barw najważniejszych wskaźników kwasowo-zasadowych | ||||
|---|---|---|---|---|
| Wskaźnik | Barwa w środowisku | Zakres pH zmiany barwy | ||
| Kwasowym | Obojętnym | Zasadowym | ||
| oranż metylowy | czerwona | żółta | żółta | 3,2÷4,4 |
| lakmus (mieszanina substancji) | czerwona | fioletowa | niebieska | 4,5÷8,2 |
| fenoloftaleina | bezbarwna | bezbarwna | malinowa | 8,2÷10,0 |
| wskaźnik uniwersalny (mieszanina substancji) | czerwona (silnie kwaśne) pomarańczowa (słabo kwaśne) | żółta | niebieska (silnie zasadowe) zielona (słabo zasadowe) | co jeden stopień skali |
| herbata | żółta | czerwona-brunatna | brązowa | |
| sok z czerwonej kapusty | fioletowa | niebieska | zielona | |
Jaką objętość zasady sodowej o stężeniu 1,0 mol/dm3 należy dodać do 56,8 g kwasu stearynowego, aby otrzymać mydło sodowe (stearynian sodu)?
| C17H35COOH + NaOH → C17H35COONa + H2O |
| (MC17H35COOH = 284 g/mol, MC17H35COONa = 306 g/mol, MNaOH = 40 g/mol, MH2O= 18 g/mol) |
Korzystając z danych w tabeli wskaż, ile cm3 36% roztworu HCl należy użyć, aby przygotować 250 cm3 0,1-molowego roztworu tego kwasu.
| % wagowy [%] | d420 [g/cm3] | m HCl w 100 cm3 [g/100cm3] | CM HCl [mol/dm3] |
|---|---|---|---|
| 30 | 1,1492 | 34,48 | 9,46 |
| 32 | 1,1593 | 37,10 | 10,17 |
| 34 | 1,1691 | 39,75 | 10,90 |
| 36 | 1,1789 | 42,44 | 11,64 |
Materiał uzyskany przez zmieszanie prób pobranych w ustalonych odstępach czasu określa się mianem próbki
Na etykiecie próbki środowiskowej należy umieścić datę jej pobrania, lokalizację poboru oraz
Podaj kolejność odczynników chemicznych według rosnącego stopnia czystości?
Jakie czynniki wpływają na zmiany jakościowe w składzie próbki?
W laboratorium chemicznym systemy wodne zazwyczaj oznacza się kolorem zielonym
Jakie metody można zastosować do rozdzielania i koncentracji składników próbki?
Proces wydobywania składnika z cieczy lub ciała stałego w mieszance wieloskładnikowej poprzez jego rozpuszczenie w odpowiednim rozpuszczalniku to
Dekantacja to metoda
Aby przyspieszyć reakcję, należy zwiększyć stężenie substratów
Metodą, która nie służy do utrwalania próbek wody, jest
Na skutek krystalizacji 18 g kwasu benzoesowego uzyskano 8 g czystego produktu. Jaką wydajność miała ta krystalizacja?
W urządzeniu Soxhleta wykonuje się
Odczynnik, który w specyficznych warunkach reaguje wyłącznie z danym jonem, umożliwiając tym samym jego identyfikację w mieszance, to odczynnik
Jaki jest błąd względny pomiaru na wadze o precyzji 0,1 g dla próbki o wadze 1 g?
Wskaż metodę rozdzielenia układu, w którym fazą rozproszoną jest ciało stałe, a fazą rozpraszającą gaz.
| faza rozproszona | faza rozpraszająca | ||
|---|---|---|---|
| gaz | ciecz | ciało stałe | |
| gaz | - | piana | piana stała |
| ciecz | aerozol ciekły | emulsja | emulsja stała |
| ciało stałe | aerozol stały | zol | zol stały |
Aby przeprowadzić analizę jakościową, próbkę mosiądzu należy roztworzyć w stężonym kwasie
Sporządzono 250 cm3 roztworu glicerolu o gęstości 1,05 g/cm3 w temperaturze 20°C. Korzystając z danych zamieszczonych w tabeli, określ stężenie procentowe sporządzonego roztworu glicerolu.
| Glicerolu [%] | 10% | 20% | 30% | 50% |
|---|---|---|---|---|
| d20 [g/dm3] | 1023,70 | 1048,40 | 1073,95 | 1127,20 |
Przy transporcie próbek wody zaleca się, aby próbki były
Roztwór o dokładnej masie z odważki analitycznej powinien być sporządzony
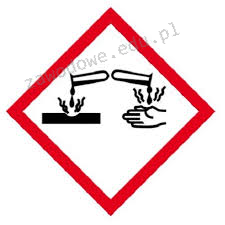
Na opakowaniu którego odczynnika powinien znaleźć się piktogram przedstawiony na ilustracji?
Na ilustracji numery rzymskie wskazują
Aby oddzielić mieszankę etanolu i wody, konieczne jest przeprowadzenie procesu
Aby otrzymać roztwór AgNO3 (masa molowa AgNO3 to 169,8 g/mol) o stężeniu 0,1 mol/dm3, należy
Jakiego koloru nabierze lakmus w roztworze NaOH?
Aby podnieść temperaturę roztworu do 330 K, jakie wyposażenie jest potrzebne?